
| A、3个 | B、4个 | C、5个 | D、6个 |


科目:高中化学 来源: 题型:
| A、N2O4和 NO2 |
| B、CO和 N2 |
| C、CO2 和NO2 |
| D、NH4+ 和HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:
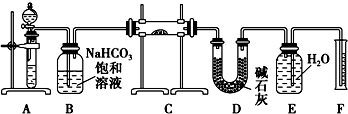
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则c(Na+)=2c(ClO-)+c(HClO) |
| B、用NaOH 溶液吸收SO2 的过程中,当n(Na2SO3):n(NaHSO3)=1:1时(溶液pH=7.2),c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) |
| C、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) |
| D、用0.1000 mol/L NaOH 滴定 25.00 mL 0.1000 mol/L某一元酸HX,恰好完全反应时c(X-)+c(HX)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②属于取代反应 |
| B、②③属于加成反应 |
| C、④⑤属于氧化反应 |
| D、⑤⑥属于聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com