
����Ŀ��������(Ca3N2)��һ����Ҫ�Ļ����Լ�����ˮ����ˮ�⡣ʵ���ҿ��ɵ����Ƽ����Ƶõ����ƣ�ʵ��װ������ͼ(ʡ�Բ��̶ֹ�װ��)��
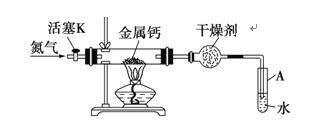
(1)�������������Ļ�ѧ����(�������ۼ����������Ӽ���)_________��
(2)���θ�����еĸ������ѡ��(����дһ��)_________����ϻ�ѧ����ʽ����������_________��
(3)�Ʊ�������ĩ�˵��ܱ���ʼ�ղ����Թ�A��ˮ�У�Ŀ���Ǣٱ��ڹ۲�N2�����٣���_________��
(4)�Ʊ������ƵIJ������裺�ٰ�ͼʾ���Ӻ�ʵ��װ�ã���_________���۴���K��ͨ��N2���ܵ�ȼ�ƾ��ƣ����з�Ӧ���ݷ�Ӧ������Ϩ��ƾ��ƣ�����ͨN2��ʹװ����ȴ�����£����װ�ã�ȡ�����
(5)���������Тۺ͢�_________(������������������)������������_________��
(6)���������Ӱ��ʵ���Ƶ�Ca3N2�Ĵ��ȡ�Ϊ�ⶨ�����ƵĴ��ȣ�ʵ�������ȡһ�����Ĺ�������������ˮ�У���ʹ������ȫ�ݳ����ռ������干6.72 L(�����㵽��״��)����������ͨ��װ����������CuO��Ӳ�ʲ������г�ַ�Ӧ�����Ӳ�ʲ������й�����������6.4 g����Ca3N2�Ĵ���Ϊ_________(�ðٷ�����ʾ������һλС��)(ע�������ܱ���������ͭ����������һ�ֶԻ�������Ⱦ����)��
���𰸡����Ӽ� ��ʯ�ҡ���ˮ�Ȼ��Ƶ� ��ֹˮ��������Ӳ�ʲ�������Ca3N2������ӦCa3N2+6H2O=3Ca(OH)2+2NH3�������²��ﲻ�� ��ֹ�����е�ˮ��������������Ӳ�ʲ����ܸ������Ʒ�Ӧ ����װ�������ԣ�����ҩƷ ���� ��ͨ�뵪���ᵼ��װ���е�������Ʒ�Ӧ����������CaO 78.7%
��������
(1)���õĽ�������õķǽ���ͨ�����Ӽ���ϣ�
(2)Ҫ��ֹCa3N2���⣬�Ӹ�����и����Ҫ�ǹ�̬���ʷ�����
(3)���ǻ��ý���������������е�������ˮ������Ӧ��
(4)������μӵĻ�ѧ��Ӧ���ڷ�Ӧǰ����Ҫ����������Ƿ����ã�Ȼ��ſ��Լ���ҩƷ����ʵ�飬����ᵼ��ʵ��ʧ�ܣ�
(5)�ڼ���ʱ�����ƻ�������е�������Ӧ��
(6)�������㣬�õ��Ĺ�̬�к���Ca��Ca3N2������ˮ�������Ʒ�Ӧ����Ca(OH)2��H2��Ca3N2����Ca(OH)2��NH3������������CuO��Ӧ��CuO+H2![]() Cu+H2O��3CuO+2NH3
Cu+H2O��3CuO+2NH3![]() 3Cu+N2+3H2O��������ٵ���������CuO��OԪ�ص����������÷�Ӧ�����ʹ�ϵ�õ�H2��NH3�����ʵ��������ɵý���Ca��Ca3N2��������������õ����ʵĴ��ȡ�
3Cu+N2+3H2O��������ٵ���������CuO��OԪ�ص����������÷�Ӧ�����ʹ�ϵ�õ�H2��NH3�����ʵ��������ɵý���Ca��Ca3N2��������������õ����ʵĴ��ȡ�
(1)���õĽ���Ca����õķǽ���N��ԭ��ͨ�����ӵ�ʧ�γ�������Ca2+��������N3-��Ȼ�����Ӽ�ͨ�����Ӽ�����γ����ӻ�����Ca3N2��
(2)������(Ca3N2)��ˮ����ˮ��, Ca3N2��ˮ�ᷢ����Ӧ��Ca3N2+6H2O=3Ca(OH)2+2NH3�����Ӷ����²��ﲻ����������ȡ������ʱҪԤ���䳱�⡣����ʢ�Ÿ�������Ǹ���ܣ�ֻ��ʹ�ù��������������ü�ʯ�ҡ���ˮ�Ȼ��ơ��轺�ȹ�̬�������
(3)��Ӳ�ʲ������е���������Ʒ�Ӧ��ȡ�����ƣ���װ�õ�ĩ�˵��ܱ���ʼ�ղ����Թ�A��ˮ�У�һ��Ŀ���DZ��ڹ۲�N2�����٣���һ��Ŀ���Ƿ�ֹ�����е�ˮ��������������Ӳ�ʲ����ܸ������Ʒ�Ӧ��
(4)��ʵ��Ŀ�����õ���������Ʒ�Ӧ��ȡ�����ƣ������ڰ�ͼʾ���Ӻ�ʵ��װ�ú�����Ҫ��������ԣ�Ȼ���ټ���ҩƷ����ʵ�飬������������ԣ���ᵼ��ʵ��ʧ�ܣ�
(5)��ʵ��Ŀ������ȡ�����ƣ�������ͨ�뵪������װ���ڵĿ���������ʱһ���ֽ����ƾ���������Ӧ���õ������ƣ�ʹ��ȡ�ĵ����Ʋ��������Ԣۺ͢�����˳���ܵߵ���
(6)�����������Ƶ�Ca3N2�к��н���Ca��������м���ˮʱ���ᷢ����Ӧ��Ca3N2+6H2O=3Ca(OH)2+2NH3����Ca+2H2O=Ca(OH)2+H2����n(H2)+n(NH3)=6.72L��22.4L/mol=0.3mol�����õ���������ﹻͨ��װ����������CuO��Ӳ�ʲ������У�������Ӧ��CuO+H2![]() Cu+H2O��3CuO+2NH3
Cu+H2O��3CuO+2NH3![]() 3Cu+N2+3H2O���ɼ���ַ�Ӧ������ٵ���������CuO��OԪ�ص����������ݷ���ʽ��֪n(CuO)=n(O)=6.4 g��16g/mol=0.4mol�����ݷ���ʽ��CuO�����巴Ӧʱ�����ʵ�����ϵ�ɵã�n(H2)+
3Cu+N2+3H2O���ɼ���ַ�Ӧ������ٵ���������CuO��OԪ�ص����������ݷ���ʽ��֪n(CuO)=n(O)=6.4 g��16g/mol=0.4mol�����ݷ���ʽ��CuO�����巴Ӧʱ�����ʵ�����ϵ�ɵã�n(H2)+![]() n(NH3)=0.4mol�����n(NH3)=0.2mol��n(H2)=0.1mol���ٸ���Ca3N2+6H2O=3Ca(OH)2+2NH3����֪��n(Ca3N2)=
n(NH3)=0.4mol�����n(NH3)=0.2mol��n(H2)=0.1mol���ٸ���Ca3N2+6H2O=3Ca(OH)2+2NH3����֪��n(Ca3N2)=![]() n(NH3)=0.1mol,m(Ca3N2)=0.1mol��148g/mol=14.8g������Ca+2H2O=Ca(OH)2+H2����֪��n(Ca)= n(H2)=0.1mol��m(Ca)= =0.1mol��40g/mol=4.0g������Ca3N2�Ĵ���Ϊ
n(NH3)=0.1mol,m(Ca3N2)=0.1mol��148g/mol=14.8g������Ca+2H2O=Ca(OH)2+H2����֪��n(Ca)= n(H2)=0.1mol��m(Ca)= =0.1mol��40g/mol=4.0g������Ca3N2�Ĵ���Ϊ![]() =78.7%��
=78.7%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 mol��L-1��KI��Һ��0.05 mol��L-1Fe2(SO4)3��Һ�������Ϻ�ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ����2Fe3++2I��![]() 2Fe2++I2������
2Fe2++I2������
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A. ������ B. ������ C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ������HA���MOH�������ϡ�
(1)��0.01mol/L��ǿ��HA��0.01mol/Lǿ��MOH��ϣ���������Һ��_______������ԡ��������ԡ����ԡ�����ͬ����
(2)��pH=3��ǿ��HA��pH=11������MOH��ϣ���������Һ��__________��
(3)��0.01mol/L��ǿ��HA��0.01mol/L����MOH��ϣ���������Һ��__________��������һ��������ӷ���ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��Ӧ���ɵĴ��������ɱ�����ã�����������ˮ���������ô��ַ�������������ˮ��Ҫ������ɹ��������������㡣�����й�˵����ȷ����
A. ����������Ԫ�س�-1�� B. ���������ڵ����
C. ������Ļ�ѧ���ʺ��ȶ� D. Cl2��ˮ�ķ�Ӧ������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�ֻ������ˮ���������ſշ��ռ����ǣ� ��
A.NOB.NH3C.H2D.CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؽ��ij������ڹؽڻ�Һ���γ������ƾ�������NaUr����ƽ���ϵΪ��Ur��(aq)+Na+(aq) ![]() NaUr(s)������Ur����ʾ��������ӡ�ҽ���������ؽ��ײ���Ҫע�Ᵽů���ر����ֽŵ��������Զ�IJ�λ����Ϊ��һ�ιؽ��ķ���������ָ���ֺ�Ĺؽڴ�����˵��
NaUr(s)������Ur����ʾ��������ӡ�ҽ���������ؽ��ײ���Ҫע�Ᵽů���ر����ֽŵ��������Զ�IJ�λ����Ϊ��һ�ιؽ��ķ���������ָ���ֺ�Ĺؽڴ�����˵��
A. �γ������ƾ���ķ�ӦΪ���ȷ�Ӧ B. �γ������ƾ���ķ�ӦΪ���ȷ�Ӧ
C. �������ܽ�Ƚϴ� D. �����ƾ���һ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. ��״���£�22.4LCCl4���еķ�����ԼΪ6.02��1023��
B. 1L����һ����1L����������
C. ����6.02��1023��Fe3+��Fe2��SO4��3��SO42�������ʵ���Ϊ3mol
D. 1molAl3+���е��������Ϊ1.806��1024��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���Լ�������ȷ���ǣ� ��
A.������ᱣ���ڲ���ϸ��ƿ��B.�������Ʊ�������ˮ��
C.���� NaOH ���Լ�ƿʹ������D.������ﮱ�����ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������д�������ƽ�⣺CO(g)+H2O(g)![]() CO2(g)+H2(g)��CO2(g)��ƽ�����ʵ���Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ������˵���������
CO2(g)+H2(g)��CO2(g)��ƽ�����ʵ���Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ������˵���������

A. ��ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)����H��0
CO2(g)+H2(g)����H��0
B. ��T2ʱ������Ӧ����״̬D����һ��������������
C. ƽ��״̬A��C��ȣ�ƽ��״̬A��c(CO)С
D. ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com