
【题目】在25℃时,将酸HA与碱MOH等体积混合。
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显_______(填“酸性”、“中性”或“碱性”,下同)。
(2)若pH=3的强酸HA与pH=11的弱碱MOH混合,则所得溶液显__________。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显__________,解释这一现象的离子方程式是__________________________。
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种物质是①6gH2;②0.5molCO2;③1.204×1024个HCl;④147g硫酸;⑤92g乙醇(C2H5OH),它们的物质的量最大的是____,所含分子数最多的是____,含有原子个数最多的是___,质量最大的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.NaOH固体溶于水不是放热反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验 编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是__________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥 C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视 E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________;
(2)在0.01mol/L的NaHCO3溶液中的物料守恒表达式为___________________;
等浓度的NaHCO3 、Na2CO3混合溶液中的电荷守恒表达式为___________________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为____________________;
(4)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化工试剂,遇水剧烈水解。实验室可由氮气和钙加热制得氮化钙,实验装置如下图(省略部分固定装置)。
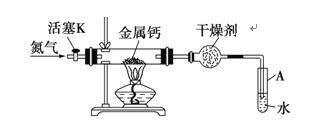
(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)_________。
(2)球形干燥管中的干燥剂可选用(至少写一种)_________,结合化学方程式解释其作用_________。
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②_________。
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②_________;③打开活塞K并通入N2;④点燃酒精灯,进行反应;⑤反应结束后,熄灭酒精灯,继续通N2,使装置冷却至室温;⑥拆除装置,取出产物。
(5)上述步骤中③和④_________(填“能”或“不能”)交换,理由是_________。
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为_________(用百分数表示,保留一位小数)(注:氨气能被灼热氧化铜氧化,生成一种对环境无污染气体)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一无摩擦、可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变)。
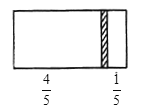
(1)右边气体的物质的量为___。
(2)右边气体中CO和CO2的质量之比为__。
(3)若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com