
ЁОЬтФПЁПвЛИіУмБеШнЦїЃЌжаМфгавЛЮоФІВСЁЂПЩздгЩЛЌЖЏЕФИєАх(КёЖШВЛМЦ)НЋШнЦїЗжГЩСНВПЗжЃЌЕБзѓБпГфШы8molN2ЃЌгвБпГфШыCOКЭCO2ЕФЛьКЯЦјЬхЙВ64gЪБЃЌИєАхДІгкШчЭМЮЛжУ(БЃГжЮТЖШВЛБф)ЁЃ
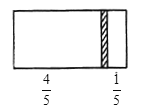
ЃЈ1ЃЉгвБпЦјЬхЕФЮяжЪЕФСПЮЊ___ЁЃ
ЃЈ2ЃЉгвБпЦјЬхжаCOКЭCO2ЕФжЪСПжЎБШЮЊ__ЁЃ
ЃЈ3ЃЉШєИФБфгвБпCOКЭCO2ЕФГфШыСПЖјЪЙИєАхДІгкОрРыгвЖЫ1/3ДІЃЌБЃГжЮТЖШВЛБфЃЌдђЧАКѓСНДЮГфШыЧщПіШнЦїФкЕФбЙЧПжЎБШЮЊ___ЁЃ
ЁОД№АИЁП2mol 21:11 5:6
ЁОНтЮіЁП
ИљОнАЂЗќйЄЕТТоЖЈТЩЕФЭЦТлЃЌЭЌЮТЁЂЭЌбЙЃЌЦјЬхЕФЬхЛ§гыЦјЬхЕФЮяжЪЕФСПГЩе§БШЁЃ
ЭЌЮТЁЂЭЌЮяжЪЕФСПЃЌЦјЬхбЙЧПгыЬхЛ§ГЩЗДБШЁЃ
ЃЈ1ЃЉгЩЭМПЩжЊзѓгвСНВрЦјЬхЕФЬхЛ§жЎБШЮЊ4:1ЃЌЙЪЦфЮяжЪЕФСПжЎБШЮЊ4:1ЃЌЫљвдгвВрЦјЬхЕФЮяжЪЕФСПЮЊ2molЁЃ
ЃЈ2ЃЉЩшCOЕФЮяжЪЕФСПЪЧxmolЃЌCO2ЕФЮяжЪЕФСПЪЧ(2-x)molЃЌ28x+44(2-x)=64ЃЌx=1.5molЃЌ COКЭCO2ЕФЕФжЪСПБШЮЊ(1.5ЁС28):(0.5ЁС44)= 21:11ЁЃ
ЃЈ3ЃЉзѓгвСНВрЦјЬхЕФбЙЧПЯрЭЌЃЌИљОнPV=nRT ЃЌЧАКѓСНДЮГфШыЦјЬхЃЌзѓВрЦјЬхЕФЮяжЪЕФСПКЭЮТЖШОљБЃГжВЛБфЃЌдђ![]() =
=![]() =
=![]() =5:6ЁЃ
=5:6ЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк25ЁцЪБЃЌНЋЫсHAгыМюMOHЕШЬхЛ§ЛьКЯЁЃ
(1)Шє0.01mol/LЕФЧПЫсHAгы0.01mol/LЧПМюMOHЛьКЯЃЌдђЫљЕУШмвКЯд_______ЃЈЬюЁАЫсадЁБЁЂЁАжаадЁБЛђЁАМюадЁБЃЌЯТЭЌЃЉЁЃ
(2)ШєpH=3ЕФЧПЫсHAгыpH=11ЕФШѕМюMOHЛьКЯЃЌдђЫљЕУШмвКЯд__________ЁЃ
(3)Шє0.01mol/LЕФЧПЫсHAгы0.01mol/LШѕМюMOHЛьКЯЃЌдђЫљЕУШмвКЯд__________ЃЌНтЪЭетвЛЯжЯѓЕФРызгЗНГЬЪНЪЧ__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаУшЪіжае§ШЗЕФЪЧЃЈ ЃЉ
A. БъзМзДПіЯТЃЌ22.4LCCl4КЌгаЕФЗжзгЪ§дМЮЊ6.02ЁС1023Иі
B. 1LЧтЦјвЛЖЈБШ1LбѕЦјжЪСПЩй
C. КЌга6.02ЁС1023ИіFe3+ЕФFe2ЃЈSO4ЃЉ3жаSO42ЉЕФЮяжЪЕФСПЮЊ3mol
D. 1molAl3+ДјгаЕФе§ЕчКЩЪ§ЮЊ1.806ЁС1024Иі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщЪдМСБЃДце§ШЗЕФЪЧЃЈ ЃЉ
A.НЋЧтЗњЫсБЃДцдкВЃСЇЯИПкЦПжаB.НЋН№ЪєФЦБЃДцдкРфЫЎжа
C.БЃДц NaOH ЕФЪдМСЦПЪЙгУЯ№НКШћD.НЋН№ЪєяЎБЃДцдкУКгЭжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЯГЩАБЖдЛЏбЇЙЄвЕКЭЙњЗРЙЄвЕОпгаживЊвтвхЁЃ
ЃЈ1ЃЉЯђКЯГЩЫўжаАДЮяжЪЕФСПжЎБШl:4ГфШыN2ЁЂH2НјааАБЕФКЯГЩЃЌЭМAЮЊTЁцЪБЦНКтЛьКЯЮяжаАБЦјЕФЬхЛ§ЗжЪ§гыбЙЧП(p)ЕФЙиЯЕЭМЁЃ

ЂйЭМAжаАБЦјЕФЬхЛ§ЗжЪ§ЮЊ15ЃЅЪБЃЌH2ЕФзЊЛЏТЪЮЊ_______ЁЃ
ЂкЭМBжаT=500ЁцЃЌдђЮТЖШЮЊ450ЁцЪБЖдгІЕФЧњЯпЪЧ_______(ЬюЁАaЁБЛђЁАbЁБ)ЁЃ
ЃЈ2ЃЉКЯГЩАБЫљашЕФЧтЦјПЩгЩМзЭщгыЫЎЗДгІжЦЕУЃЌЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊЃКCH4(g)+H2O(g)![]() CO(g)+3H2(g) ЁїH>0ЃЌвЛЖЈЮТЖШЯТЃЌдкЬхЛ§ЮЊ2 LЕФКуШнШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌИїЮяжЪЕФЮяжЪЕФСПБфЛЏШчЯТБэЃК
CO(g)+3H2(g) ЁїH>0ЃЌвЛЖЈЮТЖШЯТЃЌдкЬхЛ§ЮЊ2 LЕФКуШнШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌИїЮяжЪЕФЮяжЪЕФСПБфЛЏШчЯТБэЃК
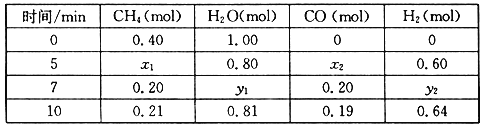
ЂйЗжЮіБэжаЪ§ОнЃЌХаЖЯ5 minЪБЗДгІЪЧЗёДІгкЦНКтзДЬЌЃП_____ЃЈЬюЁАЪЧЁБЛђЁАЗёЁБЃЉЁЃ
ЂкИУЮТЖШЯТЃЌЩЯЪіЗДгІЕФЦНКтГЃЪ§K=_____________________ЁЃ
ЂлЗДгІдк7~10 minФкЃЌCOЕФЮяжЪЕФСПМѕЩйЕФдвђПЩФмЪЧ____________ЃЈЬюзжФИЃЉЁЃ
aЃЎМѕЩйCH4ЕФЮяжЪЕФСП bЃЎНЕЕЭЮТЖШ cЃЎЩ§ИпЮТЖШ dЃЎГфШыH2
ЂмЯТСаЗНЗЈжаПЩвджЄУїЩЯЪіЗДгІвбДяЦНКтзДЬЌЕФЪЧ___________ЁЃ
aЃЎЕЅЮЛЪБМфФкЩњГЩ3n mol H2ЕФЭЌЪБЩњГЩn mol CO
bЃЎШнЦїФкбЙЧПВЛдйБфЛЏ
cЃЎЛьКЯЦјЬхУмЖШВЛдйБфЛЏ
dЃЎЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйБфЛЏ
eЃЎCH4ЕФжЪСПЗжЪ§ВЛдйБфЛЏ
ЂнвбжЊЬМЕФЦјЛЏЗДгІдкВЛЭЌЮТЖШЯТЦНКтГЃЪ§ЕФЖдЪ§жЕЃЈlgKЃЉШчЯТБэЃК
ЦјЛЏЗДгІЪН | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
дђЗДгІCO(g)+H2O(g)![]() CO2(g)+H2(g)дк900KЪБЃЌИУЗДгІЦНКтГЃЪ§ЕФЖдЪ§жЕЃЈlgKЃЉ=_______ЁЃ
CO2(g)+H2(g)дк900KЪБЃЌИУЗДгІЦНКтГЃЪ§ЕФЖдЪ§жЕЃЈlgKЃЉ=_______ЁЃ
ЃЈ3ЃЉдкШнЛ§ПЩБфЕФУмБеШнЦїжаЗЂЩњЗДгІЃКmA(g)+nB(g)![]() pC(g)ЃЌдквЛЖЈЮТЖШКЭВЛЭЌбЙЧПЯТДяЕНЦНКтЪБЃЌЗжБ№ЕУЕНAЕФЮяжЪЕФСПХЈЖШШчЯТБэ:
pC(g)ЃЌдквЛЖЈЮТЖШКЭВЛЭЌбЙЧПЯТДяЕНЦНКтЪБЃЌЗжБ№ЕУЕНAЕФЮяжЪЕФСПХЈЖШШчЯТБэ:
бЙЧПp/Pa | 2ЁС105 | 5ЁС105 | 1ЁС106 |
cЃЈAЃЉ/molL-1 | 0.08 | 0.20 | 0.44 |
ЂйЕБбЙЧПДг2ЁС105PaдіМгЕН5ЁС105PaЪБЃЌЦНКт______вЦЖЏЃЈЬюЁАе§ЯђЁЂФцЯђЛђВЛЁБЃЉЁЃ
ЂкЕБбЙЧПЮЊ1ЁС106PaЪБЃЌДЫЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПерЪЧживЊЕФЯЁШБеНТдзЪдДЃЌЙуЗКгІгУгкжкЖрЙњЗРОќЙЄМАУёгУСьгђЃЌЪєгкЮвЙњеНТдЪеДЂН№ЪєЁЃФГПЦбаПЮЬтВЩгУЕФЬсШЁерММЪѕТЗЯпЮЊЃКЕЭЦЗЮЛерОЋПѓ-ЃЈДЮбЧСзЫсФЦШШЛЙд-ецПеЛгЗЂИЛМЏЃЉ-ЛгЗЂВњЮяИпЦЗЮЛЛЙдерОЋПѓ-МюбѕЛЏдЄДІРэ-бЮЫсеєСѓЬсДП-ИпДПЫФТШЛЏер-ИпДПЖўбѕЛЏерЁЃ

ЃЈ1ЃЉдкжмЦкБэжаН№ЪєгыЗЧН№ЪєЕФЗжНчДІЃЌПЩвдевЕНАыЕМЬхВФСЯЃЌШчSiЁЂ ЕШЃЌАыЕМЬхЦїМўЕФбажЦе§ЪЧПЊЪМгк ЃЌКѓРДЗЂеЙЕНбажЦгыЫќЭЌзхЕФ ЁЃШ§жждЊЫивРДЮЪЧ_______ЃЈЬюБъКХЃЉЁЃ
aЃЎGe Si Ge
bЃЎGe Ge Si
cЃЎC Si Ge
ЃЈ2ЃЉЧыХфЦНДЮбЧСзЫсФЦШШЛЙдЗДгІЕФЛЏбЇЗНГЬЪНВЂдкРЈКХФкзЂУїЗДгІЬѕМўЃК
___NaH2PO2ЁЄH2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeOЁќ+___H3PO4ЃЌ_____________
___Na4P2O7+___H2O+___GeOЁќ+___H3PO4ЃЌ_____________
ЃЈ3ЃЉИпЦЗЮЛЛЙдерОЋПѓМюбѕЛЏдЄДІРэЙ§ГЬЕФВњЮяЪЧерЫсФЦЃЌЧыаДГіИУЙ§ГЬЕФЛЏбЇЗДгІЗНГЬЪНЃК____________________________________________
ЃЈ4ЃЉИпДПЖўбѕЛЏерКЌСПВЩгУЕтЫсМиЕЮЖЈЗЈНјааЗжЮіЁЃГЦШЁ3.600gИпДПЖўбѕЛЏербљЦЗЃЌВЩгУЧтбѕЛЏФЦдкЕчТЏЩЯШмбљЃЌДЮбЧСзЫсФЦМгШШЛЙдЃЌШЛКѓвдЕэЗлЮЊжИЪОМСЃЌгУЕтЫсМиБъзМШмвКЃЈ0.6000mol/LЃЉЕЮЖЈЃЌЯћКФЕФЕтЫсМиЬхЛ§ЮЊ19.00mLЁЃ[20ЁцвдЯТЃЌДЮбЧСзЫсФЦВЛЛсБЛЕтЫсМиКЭЕтбѕЛЏ]
ЂйЕЮЖЈжеЕуЕФЯжЯѓЪЧ_____________________________ЁЃ
ЂкДЫбљЦЗжаЖўбѕЛЏерКЌСПЪЧ_________ЁЃЃЈБЃСєЫФЮЛгааЇЪ§зжЃЉ
ЃЈ5ЃЉгУЧтЦјЛЙдGeO2ПЩжЦЕУН№ЪєерЁЃЦфЗДгІШчЯТЃК
GeO2+ H2= GeO+ H2O Ђй
GeO+ H2= Ge+ H2O Ђк
GeO2+ 2H2= Ge+ 2H2O Ђл
ЗДгІЪНЂлІЄH=+13750 kJ/mol ЃЌІЄS=+15600J/(KЁЄmolЃЉЃЌдђЛЙдЗДгІЕФЮТЖШвЛАуПижЦдк_________ЁцЗЖЮЇФкЁЃ[вбжЊGeOдк700ЁцЛсЩ§ЛЊЃЌT(K)=t(Ёц)+273]
ЃЈ6ЃЉердкЯѕЫсжаЕФШмНтЫйЖШЪмЯѕЫсХЈЖШЁЂНСАшЫйЖШЁЂЮТЖШЕШвђЫигАЯьЁЃШчЭМЃЌерШмНтЫйЖШгавЛзюДѓжЕЃЌЯѕЫсЕФХЈЖШаЁгкДЫжЕЪБЃЌЫцХЈЖШдіМгШмНтЫйЖШдіМгЃЌЗДжЎНЕЕЭЃЌетЪЧгЩгкЯѕЫсХЈЖШИпЪБ_________МгОчЫљжТЁЃ
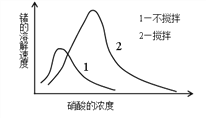
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂё. ЃЈ1ЃЉЯТСаЬѕМўЕФИФБфФмдіДѓЛюЛЏЗжзгАйЗжЪ§ЕФЪЧ_____________ЁЃ
A.діДѓбЙЧП B.діДѓЗДгІЮяЕФХЈЖШ
C.Щ§ИпЮТЖШ D.ЪЙгУДпЛЏМС
ЃЈ2ЃЉЦЦЛЕЃЈЛђаЮГЩЃЉ1 molЛЏбЇМќЫљЮќЪеЃЈЛђЗХГіЃЉЕФФмСПГЦЮЊМќФмЁЃвбжЊАзСзКЭPCl3ЕФЗжзгНсЙЙШчЭМЫљЪОЃЌЯжЬсЙЉвдЯТЛЏбЇМќЕФМќФмЃЈkJЁЄmol-1ЃЉЃКP-P 198ЁЂCl-Cl 243ЁЂP-Cl 331ЁЃ

дђЗДгІP4ЃЈsЃЌАзСзЃЉ+6Cl2ЃЈgЃЉ=4PCl3ЃЈsЃЉЕФЗДгІШШЁїH=__________kJЁЄmol-1ЁЃ
Ђђ.2SO2ЃЈgЃЉ+O2ЃЈgЃЉ![]() 2SO3ЃЈgЃЉЗДгІЙ§ГЬЕФФмСПБфЛЏШчЭМЫљЪОЁЃ
2SO3ЃЈgЃЉЗДгІЙ§ГЬЕФФмСПБфЛЏШчЭМЫљЪОЁЃ

вбжЊ1mol SO2ЃЈgЃЉбѕЛЏЮЊ1mol SO3ЃЈgЃЉЕФЁїH=-99 kJЁЄmol-1ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭМжаCБэЪО___________ЃЌEБэЪО______________ЃЛИУЗДгІЭЈГЃгУV2O5зїДпЛЏМСЃЌМгV2O5ЛсЪЙЭМжаBЕуНЕЕЭЃЌРэгЩЪЧ____________ ЃЛ
ЃЈ2ЃЉЭМжаЁїH=_________kJЁЄmol-1ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуШнУмБеШнЦїжаДцдкЯТСаЦНКтЃКCO(g)+H2O(g)![]() CO2(g)+H2(g)ЁЃCO2(g)ЕФЦНКтЮяжЪЕФСПХЈЖШc(CO2)гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
CO2(g)+H2(g)ЁЃCO2(g)ЕФЦНКтЮяжЪЕФСПХЈЖШc(CO2)гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. ЗДгІCO(g)+H2O(g)![]() CO2(g)+H2(g)ЕФІЄHЃО0
CO2(g)+H2(g)ЕФІЄHЃО0
B. дкT2ЪБЃЌШєЗДгІДІгкзДЬЌDЃЌдђвЛЖЈгаІЭе§ЃМІЭФц
C. ЦНКтзДЬЌAгыCЯрБШЃЌЦНКтзДЬЌAЕФc(CO)аЁ
D. ШєT1ЁЂT2ЪБЕФЦНКтГЃЪ§ЗжБ№ЮЊK1ЁЂK2ЃЌдђK1ЃМK2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПt ЁцЪБЃЌЫЎЕФРызгЛ§ЮЊKwЃЌИУЮТЖШЯТНЋa molЁЄL-1ЕФвЛдЊЫсHAгыb molЁЄL-1ЕФвЛдЊМюBOHЕШЬхЛ§ЛьКЯЃЌвЊЪЙЛьКЯвКГЪжаадЃЌБивЊЕФЬѕМўЪЧ
A. ЛьКЯвКжаc(HЃЋ)ЃН![]() B. ЛьКЯвКЕФpHЃН7
B. ЛьКЯвКЕФpHЃН7
C. aЃНb D. ЛьКЯвКжаc(BЃЋ)ЃНc(A-)ЃЋc(OH-)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com