
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() B. 混合液的pH=7
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
【答案】A
【解析】
根据溶液中c(H+)与c(OH-)的相对大小,可判断出溶液的酸碱性。题设中溶液呈中性,则其必要的条件是c(H+)=c(OH-),
A. 根据Kw=c(H+)·c(OH-),若溶液呈中性,则c(H+)=c(OH-),进而得出结论;
B. pH = -lgc(H+),其值只与c(H+)有关,不能直接判断出c(H+)是否与c(OH-)相等;
C. HA与BOH是否是强酸或强碱未知;
D. 该式不符合电荷守恒式。
题设中溶液呈中性,则其必要的条件是c(H+)=c(OH-),
A. 因Kw=c(H+)·c(OH-),若溶液显中性,则c(H+)=c(OH-),推出Kw = c2(H+),即c(H+)=![]() ,故A项正确;
,故A项正确;
B. pH = 7的溶液只有在25℃才是中性,在其他温度下溶液不是中性,则不是必要条件,故B项错误;
C. HA与BOH是否是强酸或强碱未知,则a=b时,HA与BOH恰好完全反应,但混合后生成的盐溶液不一定呈中性,故C项错误;
D. 根据电荷守恒等式知:c(H+)+c(B+)=c(A-)+c(OH-),故D项错误;
答案选A。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一无摩擦、可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变)。
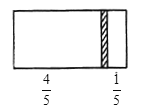
(1)右边气体的物质的量为___。
(2)右边气体中CO和CO2的质量之比为__。
(3)若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.保护环境,提倡“低碳生活”,是我们都应关注的社会问题。目前,一些汽车已改用天然气(CNG)做燃料,以减少对空气污染。已知:16g甲烷完全燃烧生成液压态水放出890kJ热量,1mol碳完全燃烧生成二氧化碳放出393.5kJ热量,通过计算比较,填写下列表格(精确到0.01):
物质质量1g | 燃烧放出的热量/kJ | 生成CO2的质量/g |
碳 | 32.80 | _________ |
甲烷 | _________ | 2.75 |
根据表格中的数据,天然气与煤相比,用天然气做燃料的优点是 ____________。
II.联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H1 = -90.7kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H2 = -23.5kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H3= -41.2kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:_____________________________ 。
(2)恒温下,一体积固定的密闭容器中存在反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,若增大CO的浓度,则此反应的焓变___________(填“增大”、“减小”、“不变”)。
CO2(g)+H2(g) △H<0,若增大CO的浓度,则此反应的焓变___________(填“增大”、“减小”、“不变”)。
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成 甲醇:CO(g)+2H2(g)![]() CH3OH(g), CO的平衡转化率与温度、压强的关系如图所示,则:p1_______________ p2 (填“>”、 “<”或“ = ”,下同),该反应的△H___________0。
CH3OH(g), CO的平衡转化率与温度、压强的关系如图所示,则:p1_______________ p2 (填“>”、 “<”或“ = ”,下同),该反应的△H___________0。

(4)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=akJ·mol-1、E(P-O)=bkJ·mol-1、E(O=O)=ckJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为(反应热用a、b、c表示):_____________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,2 L密闭容器中充入0.40 mol N2O4,发生反应N2O4(g)![]() 2NO2(g) ΔH=+53 kJ/mol,获得如下数据。下列判断正确的是
2NO2(g) ΔH=+53 kJ/mol,获得如下数据。下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 该反应的 ΔS <0
C. 反应达平衡时吸热15.9 kJ
D. 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题
(1)在实验室进行步骤A操作,需要用到的仪器名称为___________。
(2)步骤C中得到的滤渣主要成分是CaSO4和___________,步骤D中还原剂与氧化剂的物质的量之比为___________。
(3)步骤E中调节pH的范围为___________,其目的是______________________。
(4)步骤G发生的离子方程式为_________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为Mn2++S2O82-+H2O→H++SO42-+MnO4-,确认Mn2+离子已经完全反应的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述正确的是

A. 图中涉及的物质都是电解质
B. SO2→SO3的过程是吸热过程
C. 图中涉及的无机化合物在一定条件下均具有氧化性
D. 理论上图中氧化物和水的反应都能设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯![]() 的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
A. CH2=CH2和CO B. CO和CH3OH C. CH3OH和H2 D. CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com