
【题目】开发和利用矿物资源有重要的意义。某厂用无机矿物资源生产部分材料,其产品流程示意图如下,下列有关说法不正确的是( )

A. 制取粗硅时生成的气体产物为CO
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 黄铜矿冶炼铜时,产生的SO2可用于生产硫酸,产生的FeO可用作冶炼铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
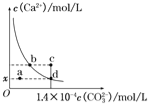
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
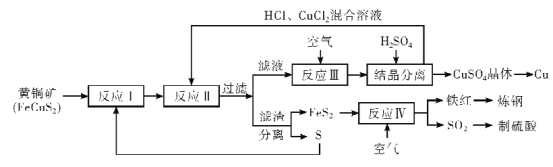
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中S的化合价____。
(2)反应I在隔绝空气、高温煅烧条件下进行,写出化学方程式____。
(3)为了反应I充分进行,工业上可采取的措施是____。
(4)反应III的离子方程式为____。
(5)向反应III后的溶液中加入稀硫酸的目的是____。
(6)该流程中,可循环利用的物质除CuCl2外,还有___(填化学式)。
(7)反应IV中,处理尾气SO2的方法,合理的是_____
A.高空排放
B.用BaCl2溶液吸收制备BaSO3
C.用氨水吸收后,再经氧化,制备(NH4)2SO4
D.用纯碱溶液吸收可生成Na2SO3(H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;H2SO3:Ka1=1.2×102,Ka2=5.6×108)
(8)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq)
Cu2S(s)+2Cl-(aq)
该反应的平衡常数K=___[已知Ksp(CuCl)=a,Ksp(Cu2S)=b]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有KOH和Ca(OH)2的混合溶液,pH=13。取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是

A. 560、672B. 1008、1120
C. 2240、2352D. 392、504
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种绿色能源。如图所示,某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.

根据要求回答相关问题:
(1)写出负极的电极反应式__________________________________.
(2)铁电极为______(填“阳极”或“阴极” ),石墨电极(C)的电极反应式为______________.
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为______g。假设乙装置中溶液足量,若在标准状况下有448mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将增加_______g.
(4)若将乙装置中两电极位置互换,其他装置不变,此时乙装置中发生的总反应式________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
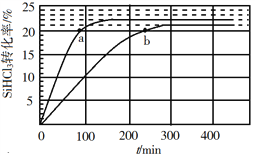
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol·L-1Na2CO3溶液中Na+的数目为0.2NA
B.标准状况下,2.24LCCl4中的分子数目为0.1NA
C.常温常压下,17g氨气中所含氢原子数目为3NA
D.3.2g由O2和O3组成的混合物含有分子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com