
����Ŀ��ͭ����������ʹ�õĽ�����������������Ӧ�ü���㷺����ҵ���Ի�ͭ�� (��Ҫ�ɷ�FeCuS2)Ϊԭ����ȡ����ͭ������Ҫ����������ͼ��ʾ��
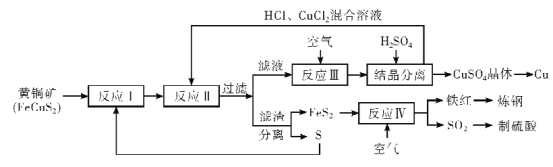
��֪����ӦII�����ӷ���ʽ��Cu2++CuS+4Cl-=2[CuCl2]-+S
�ش��������⣺
��1��FeCuS2��S�Ļ��ϼ�____��
��2����ӦI�ڸ����������������������½��У�д����ѧ����ʽ____��
��3��Ϊ�˷�ӦI��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ��____��
��4����ӦIII�����ӷ���ʽΪ____��
��5����ӦIII�����Һ�м���ϡ�����Ŀ����____��
��6���������У���ѭ�����õ����ʳ�CuCl2�⣬����___���ѧʽ����
��7����ӦIV�У�����β��SO2�ķ�������������_____
A���߿��ŷ�
B����BaCl2��Һ�����Ʊ�BaSO3
C���ð�ˮ���պ��پ��������Ʊ�(NH4)2SO4
D���ô�����Һ���տ�����Na2SO3��H2CO3��Ka1=4.4��10-7��Ka2=4.7��10-11��H2SO3��Ka1=1.2��102��Ka2=5.6��108��
��8��CuCl����Һ�м���Na2S�������ķ�ӦΪ2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq)
Cu2S(s)+2Cl-(aq)
�÷�Ӧ��ƽ�ⳣ��K=___[��֪Ksp(CuCl)=a��Ksp(Cu2S)=b]
���𰸡�-2 FeCuS2+S��������FeS2+CuS �������� 4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O ����ͬ�����£�CuSO4���ܽ�ȵ����������ʣ�����H2SO4�������������� S��H2SO4��HCl CD ![]()
��������
����ʵ��Ŀ�Ļ�ͭ�� (��Ҫ�ɷ�FeCuS2)Ϊԭ����ȡ����ͭ����ϸ����ֵķ�Ӧ��ϵ�����ʵ����ʻش���Ӧ�����⡣��1�����ݻ��ϼ۴�����Ϊ�����Ԫ���ڻ������еĻ��ϼۡ���2������������ԭ��Ӧԭ����д��ѧ��Ӧ����ʽ����3������Ӱ�컯ѧ��Ӧ���ʵ�����Ѱ�Ҽӿ����ʵķ��������ݳ����ܽ�ƽ��ͻ�ѧƽ�ⳣ���Ĺ�ϵȷ����
��1�����ݻ��ϼ۴�����Ϊ���ԭ��FeΪ+2�ۣ�CuΪ+2�ۣ���FeCuS2��S�Ļ��ϼ�-2���𰸣�-2��
��2����ͭ����Ҫ�ɷ�FeCuS2����ӦI�ڸ����������������������½��У����FeCuS2������Ӧ����FeS2��CuS����ѧ����ʽΪ��FeCuS2+S![]() FeS2+CuS���𰸣�FeCuS2+S
FeS2+CuS���𰸣�FeCuS2+S![]() FeS2+CuS��
FeS2+CuS��
��3��Ϊ�˷�ӦI��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ�ǽ���ʯ������ֽ��裬������Ӵ�������ӿ컯ѧ��Ӧ���ʡ��𰸣��������衣
��4���ɷ�ӦII�����ӷ���ʽ��Cu2++CuS+4Cl-=2[CuCl2]-+S�������˿�֪��Һ�к���[CuCl2]-��H+�����ӣ�ͨ�������[CuCl2]-�е�+1��ͭ���������������Է�ӦIII�����ӷ���ʽΪ4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O���𰸣�4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O��
��5����Ϊ����ͬ�����£�CuSO4���ܽ�ȵ����������ʣ�������ӦIII�����Һ�м���ϡ�����Ŀ����ʹCuSO4��ɾ����������𰸣�����ͬ�����£�CuSO4���ܽ�ȵ����������ʣ�����H2SO4����������������
��6����������ͼ������֪���������п�ѭ�����õ�������CuCl2��S��H2SO4��HCl���𰸣�S��H2SO4��HCl��
��7��A.���������ж�,����ֱ�Ӹ߿��ŷ�,�������Ⱦ����,Ӧ���ü�Һ����,��A����;B.�������Դ���������,���Զ��������BaCl2����Ӧ,�����ö���������Ȼ�����Һ��ȡBaSO3,��B����;C.�������������������һˮ�ϰ��Ǽ�,���߷�Ӧ�����������, ������鱗��ȶ����ױ�����������泥������ð�ˮ���պ�,�پ������Ʊ������,��C��ȷ��;D.���������ˮ��Ӧ���ɵ����������Դ���̼��,���Զ��������ܺʹ�����Һ��Ӧ������������,�����ô�����Һ�����Ʊ�������������ȷ�ģ���D��ȷ���𰸣�CD��
��8��CuCl����Һ�м���Na2S�������ķ�ӦΪ2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),��Ӧ��ƽ�ⳣ��K=c2(Cl-)/c(S2-)=Ksp2(CuCl)/Ksp(Cu2S)=
Cu2S(s)+2Cl-(aq),��Ӧ��ƽ�ⳣ��K=c2(Cl-)/c(S2-)=Ksp2(CuCl)/Ksp(Cu2S)=![]() ,�𰸣�
,�𰸣�![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���µ��йص������Һ��˵������ȷ���ǣ� ��
A. ��Na2CO3��Һ��ͨ��NH3�� 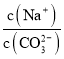 ��С
��С
B. ��0.1mol��L-1��K2C2O4��Һ��25��������35�棬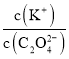 ����
����
C. ��0.1mol��L-1��HF��Һ�еμ�NaOH��Һ�����ԣ� 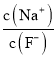 =1
=1
D. ��0.1mol��L-1��CH3COONa��Һ�м�������ˮ��  ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪ������Ϊ����֤��һ��ʵ��ijͬѧ������ͼװ�ý���ʵ�飨ʵ��ʱѹǿΪ10lkPa���¶�Ϊ0������
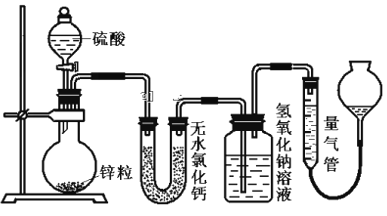
��1��������ƿ�з���1.30gп������c mol��L H2SO4��Ӧ��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹����_____________ ��ѡ�200��400��500�� mL ��
��2����1.30gп����ȫ�ܽ⣬��������ϴ��ƿ����l.28g ����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ��_______________________
��3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g������ƿ���ռ���V m�����壬���У� ![]() ��
��![]() ��
��![]() �����ݵ�ԭ����____________________________��
�����ݵ�ԭ����____________________________��
��4��������ƿ��Ͷ��d gп������һ������c mol��L Ũ����V L����ַ�Ӧ��п��ʣ�࣬�����������ϴ��ƿ����m g��������ʵ����̲����������У�![]() ��_______________���ú���ĸ�Ĵ���ʽ��ʾ����
��_______________���ú���ĸ�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���á��ѳ�Ϊȫ�����ѧ���о�����Ҫ���⣬���ۺ����þ�����Ҫ���塣�ش��������⣺
��1��CO2��CH4�����������Ƶúϳ�����CH4��g��+ CO2��g��![]() 2CO ��g��+ 2H2��g��
2CO ��g��+ 2H2��g��
����֪������Ӧ����صĻ�ѧ�������������£�
��ѧ�� | C��H | C=O | H��H | C |
����/kJ��mol1 | 413 | 745 | 436 | 1075 |
��÷�Ӧ�Ħ�H=_________�����������CH4ƽ��ת���ʵ�������____�����ţ���
A.���µ�ѹ B.���¸�ѹ C.���¸�ѹ D.���µ�ѹ
��ij�¶��£������Ϊ2 L�������м���2 mol CH4��1 mol CO2�Լ���������������Ӧ���ﵽƽ��ʱCO2��ת������50%����ƽ�ⳣ��Ϊ_______mol2��L-2��
��2��CO2���Ա�NaOH��Һ������������Һc��HCO3����c��CO32 -��=2��1����ҺpH=____���������£�H2CO3��K1=4��10-7��K2=5��10-11����0.1mol��L-1 NaHCO3��Һ�������ӵ�Ũ���ɴ�С��˳��Ϊ______________
��3���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ������_______�����õ缫��Ӧʽ��___________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ�dz��õ�һ��ʳ���㾫����������ת����ϵ��
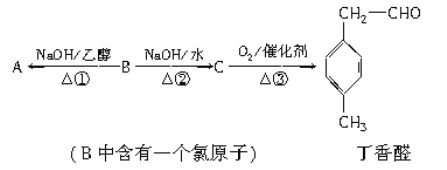
(1)B�ķ���ʽΪ________��C�к��������ŵ�����Ϊ________��
(2)��Ӧ�ڵĻ�ѧ����ʽΪ____________________________________��
(3)A�����Ӿ۷�Ӧ���ò���Ľṹ��ʽΪ________________��
(4)��A������ͬ�����ŵķ����廯�����ͬ���칹�廹��________��(������˳���칹)������ֻ��һ��ȡ�����Ҳ����������ʵĽṹ��ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ʵ�����������Ӧ��������������ϵ����ȷ����
ѡ�� | ʵ������ | ʵ���������� |
A | �ֱ���4 mL 0.1 mol/L ��4 mL 0.2 mol/L KMnO4��Һ����2 mL 0.1 mol/L H2C2O4��Һ����¼��ɫʱ�� | Ũ��Խ��Ӧ����Խ��Խ����ɫ |
B | 25��ʱ����pH=1������ʹ����0.5L����Һ�и�����1.4g���� | ����������H2�����ʿ��������������� |
C | ��ʯīΪ�缫�����KI��Һ(���к���������̪) | �����ݳ������Ҹ�����Һ���ֺ�ɫ |
D | ��FeCl3+3KSCN | Ѫ��ɫ��dz��˵������������Ũ�ȣ�ƽ�������ƶ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ�������Ͷ��һ������X��Y���ڴ����������·�����Ӧ��X(g) + Y(g)![]() Z(g)����Ӧ�����вⶨ�IJ����������±�:
Z(g)����Ӧ�����вⶨ�IJ����������±�:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
����˵����ȷ����
A. ��Ӧ1~2minĩ��ƽ������v(Z)=0.2mol/(L��min)
B. ��2min~4min�䣬v(X)��>v(Y)��
C. ����1mol Z��ͬʱ������1mol X��˵���÷�Ӧ�Ѵﻯѧƽ��״̬
D. �����������䣬�ٳ���1.2mol X��X��ת���ʽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ÿ�����Դ����Ҫ�����塣ij������������Դ�������ֲ��ϣ����Ʒ����ʾ��ͼ���£������й�˵������ȷ����(����)

A. ��ȡ�ֹ�ʱ���ɵ��������ΪCO
B. ��������ͭ���ߴ��輰�����Ĺ����ж��漰������ԭ��Ӧ
C. ��ͭ��ұ��ͭʱ��������SO2�������������ᣬ������FeO������ұ������ԭ��
D. �ֹ��Ƹߴ���ʱ���ᴿ���Ȼ�����ö�η���ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ� 1 mol ij��ѧ�������ĵ����������Ǹû�ѧ���ļ��ܡ����ܵĴ�С�ɺ�����ѧ����ǿ����Ҳ���Թ��㻯ѧ��Ӧ�ķ�Ӧ�ȡ��±�ΪijЩ��ѧ���ļ���
��ѧ�� | N-N | O=O | N��N | N-H |
����(kJ/mol) | 154 | 500 | 942 | a |
��֪���ȼ���£�![]() �����йػ�ѧ��Ӧ�������仯��ͼ��ʾ��������˵��������ǣ� ��
�����йػ�ѧ��Ӧ�������仯��ͼ��ʾ��������˵��������ǣ� ��

A.N2��O2�ȶ�
B.N2H4(g)��O2(g)=N2(g)��2H2O(g) ��H=��534 kJ/mol
C.���е� a��194
D.ͼ�е� ��H3=��2218 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com