
【题目】下到有关电解质溶液的说法不正确的是( )
A. 向Na2CO3溶液中通入NH3, 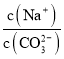 减小
减小
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,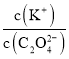 增大
增大
C. 向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性, 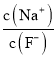 =1
=1
D. 向0.1mol·L-1的CH3COONa溶液中加入少量水, 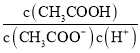 增大
增大
【答案】D
【解析】A项,Na2CO3溶液中存在平衡CO32-+H2O![]() HCO3-+OH-,通入NH3,NH3溶于水生成NH3H2O,存在电离NH3H2O
HCO3-+OH-,通入NH3,NH3溶于水生成NH3H2O,存在电离NH3H2O![]() NH4++OH-,抑制了CO32-的水解,c(CO32-)增大,又因为c(Na+)不变,所以
NH4++OH-,抑制了CO32-的水解,c(CO32-)增大,又因为c(Na+)不变,所以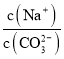 减小,故A正确;B项,K2C2O4溶液中存在C2O42-水解,水解吸热,若从25℃升温至35℃,促进了C2O42-的水解,c(C2O42-)减小,又因为c(Na+)不变,所以
减小,故A正确;B项,K2C2O4溶液中存在C2O42-水解,水解吸热,若从25℃升温至35℃,促进了C2O42-的水解,c(C2O42-)减小,又因为c(Na+)不变,所以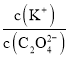 增大,故B正确;C项,向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性,根据电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-),c(H+)=c(OH-),则c(Na+)=c(F-),即
增大,故B正确;C项,向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性,根据电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-),c(H+)=c(OH-),则c(Na+)=c(F-),即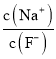 =1,故C正确;D项,CH3COOH的电离常数Ka=
=1,故C正确;D项,CH3COOH的电离常数Ka=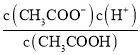 ,所以
,所以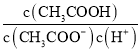 =
=![]() ,电离常数只受温度影响,温度不变则Ka不变,故D错误。
,电离常数只受温度影响,温度不变则Ka不变,故D错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S![]() 2H++ S2-
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。

(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g) + H2O(g)=CO(g) +3H2(g) △H=+206.2 kJ/mol
CH4(g) + CO2(g)=2CO(g) +2H2(g) △H=+247.4 kJ/mol
2H2S(g)=2H2(g) +S2(g) △H=+169.8 kJ/mol
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
(2)①H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_________________________________。
②燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式________________________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是_________________。
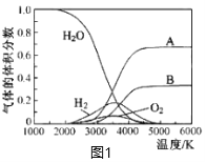
(4)将1 molCO和2 molH2充入恒容密闭容器中,在催化剂作用下发生如下反应:CO(g) + 2H2(g)![]() CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图2所示。A、B、C三点的化学平衡常数K(A)、K(B)、K(C)的相对大小为_______________,计算C点的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图2所示。A、B、C三点的化学平衡常数K(A)、K(B)、K(C)的相对大小为_______________,计算C点的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于相同体积pH均为3的醋酸和盐酸,下列说法正确的是
A. 稀释10倍后,两者的pH变化醋酸大于盐酸
B. 中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸
C. 加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
D. 加入足量的锌粉,产生氢气的速率随时间的变化如图所示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法不正确的是
A. 1mol O2与金属钠反应,O2不一定得到4NA个电子
B. 标准状况下,a L CH4和a L C6H14中所含分子数均为![]()
C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月8日iphone7发布,软磁铁氧体是生产手机必不可少的材料,这种材料的原料之一是四氧化三锰。四氧化三锰的制法有焙烧法和还原法,某生产流程4:

(1)写出反应②的化学方程式:____________________________。实验室焙烧固体时用到的硅酸盐仪器是______________。
(2)通常所说的四氧化三锰中,锰元素的价态既有+2,可能也有+3和+4价。
假设一:锰的价态是+2和+4价。
假设二:锰的价态是____________。
假设三:锰的价态是_______________。
(3)查阅资料得知硫酸铵-硫酸溶液可选择性溶解试样中的二价锰。基于假设一成立,某化学兴趣小组同学进行如下表的研究,请完成表中的内容:
实验步骤(不要求写详细的操作过程) | 预期的实验结果和结论 |
①准确称取6.87克Mn3O4样品 | |
② | |
③ | |
④称量剩余固体的质量 |
(4)用高锰酸钾标准溶液滴定未知浓度的草酸氢钾溶液,滴定终点的标志是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
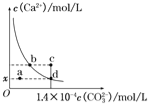
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
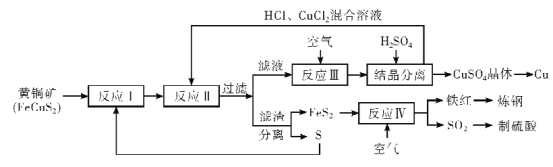
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中S的化合价____。
(2)反应I在隔绝空气、高温煅烧条件下进行,写出化学方程式____。
(3)为了反应I充分进行,工业上可采取的措施是____。
(4)反应III的离子方程式为____。
(5)向反应III后的溶液中加入稀硫酸的目的是____。
(6)该流程中,可循环利用的物质除CuCl2外,还有___(填化学式)。
(7)反应IV中,处理尾气SO2的方法,合理的是_____
A.高空排放
B.用BaCl2溶液吸收制备BaSO3
C.用氨水吸收后,再经氧化,制备(NH4)2SO4
D.用纯碱溶液吸收可生成Na2SO3(H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;H2SO3:Ka1=1.2×102,Ka2=5.6×108)
(8)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq)
Cu2S(s)+2Cl-(aq)
该反应的平衡常数K=___[已知Ksp(CuCl)=a,Ksp(Cu2S)=b]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com