
【题目】下表是氧化镁和氯化镁的熔、沸点数据:
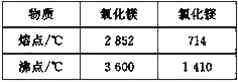
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2晶体
MgCl2溶液→MgCl2晶体![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg
Mg
【答案】D
【解析】
A.在实际生产中从海水提取MgCl2,用石灰乳而不用NaOH,另外电解氢氧化镁不能得到金属镁,应该电解熔融的氯化镁,故A错误;
B.海水中存在的是氯化镁,加入盐酸不能富集浓缩得到氯化镁溶液,故B错误;
C.过程中氧化镁熔点高,电解消耗大量的能量,应该电解熔融的氯化镁制备镁,故C错误;
D.海水中含有镁离子,向海水中加入石灰乳,将镁离子转化为Mg(OH)2沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,再将Mg(OH)2溶于稀盐酸得到MgCl2溶液,反应为Mg(OH)2+2HCl=MgCl2+2H2O,氯化镁易水解生成氢氧化镁,为防止水解,将MgCl2溶液在HCl氛围中蒸发得到MgCl2,氯化镁熔点较低、氧化镁熔点较高,为降低成本,电解熔融MgCl2得到金属Mg,故D正确;
故选D。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应P(g)+Q(g)![]() R(g)+S(g)在体积和温度不变的密闭容器中进行。下列事实中,可作为反应达到化学平衡状态的标志的是
R(g)+S(g)在体积和温度不变的密闭容器中进行。下列事实中,可作为反应达到化学平衡状态的标志的是
A.单位时间内生成n mol Q的同时生成n mol R
B.单位时间内生成n mol R 的同时生成n mol S
C.反应器内P、Q、R、S四种气体物质的量浓度相等
D.反应器内P、Q、R、S四种气体共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
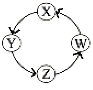
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
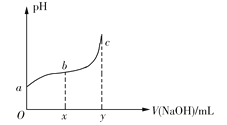
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
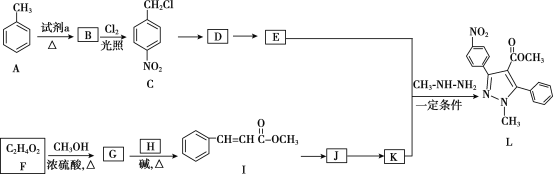
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成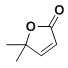 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,1L水中可溶解0.09molCl2,实验测得溶于水的Cl2约有三分之一与水反应。下列说法正确的是
A.氯气与水反应的离子反应方程式为:Cl2 + H2O ![]() 2H+ + Cl—+ ClO—
2H+ + Cl—+ ClO—
B.为了增大氯水中HClO的浓度,可以向氯水中加入足量的NaOH固体,使氯气与水反应的平衡向右移动
C.向该条件下的氯水中加入盐酸,氯气与水反应的平衡移动方向与盐酸的浓度有关
D.向氯水中通入HCl气体,氯气与水反应的平衡向左移动,氯水的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中制备纯碱和金属镁的流程如下图所示:
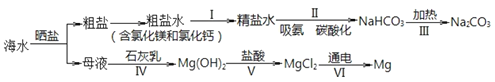
下列说法不正确的是
A.流程 I 依次向粗盐水中加入过量 Ca(OH)2 溶液、Na2CO3 溶液并过滤
B.流程 II 吸氨是使溶液呈碱性,有利于吸收二氧化碳
C.海水提镁流程中涉及到三种基本反应类型
D.流程 IV、V 是通过化学方法富集镁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入25 mL 2mol/L的氯化铁溶液中,充分反应后,其结果是
A. 铁有剩余,溶液呈浅绿色,Cl- 浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. 氧化产物与还原产物的物质的量之比为2∶5
D. Fe2+和Fe3+的物质的量之比为6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:
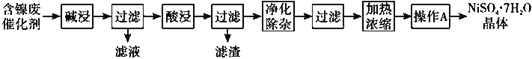
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为2A1+2OH-+2H2O=2AlO2—+3H2↑,_________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,此时的pH为____________(保留1位小数)。
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在NaOH溶液中可被NaClO氧化为NiOOH,该反应的化学方程式为_______。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其充电时,正极的电极反应式为____________。
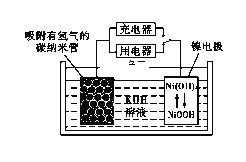
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com