
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Na(s)![]() Na2O(s)
Na2O(s)![]() NaOH(aq)
NaOH(aq)
B.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq)![]() Al(s)
Al(s)
C.CaSO4(s)![]() CaCO3(s)
CaCO3(s)![]() Ca(NO3)2(aq)
Ca(NO3)2(aq)
D.Fe2O3(s)![]() Fe(s)
Fe(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
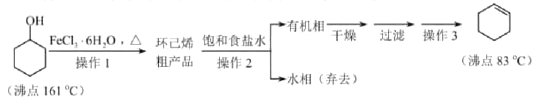
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
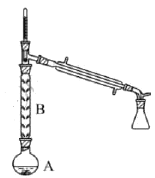
①烧瓶A中进行的可逆反应化学方程式为________________________,浓硫酸也可作该反应的催化剂,选择![]() 而不用浓硫酸的原因为________________________(填序号)。
而不用浓硫酸的原因为________________________(填序号)。
a.浓硫酸易使原料碳化并产生![]()
b.![]() 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念
c.同等条件下,用![]() 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高
②仪器B的作用为____________。
(3)操作2用到的玻璃仪器是____________。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向![]() 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的![]() ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的![]() 与足量
与足量![]() 作用生成
作用生成![]() ,用
,用![]() 的
的![]() 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗![]() 标准溶液
标准溶液![]() (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①![]()
②![]()
③![]()
(5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。
(6)下列情况会导致测定结果偏低的是____________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.![]() 标准溶液部分被氧化
标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() 3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molBB.3molC+ 1molD+ 1molB
C.6molC + 0.8molDD.1.6molA+0.8molB + 0.6molC+0.3molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:

已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。

(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }
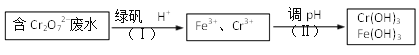
① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子的结构、性质及用途如表所示:
元素 | 结构、性质及用途 |
A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
B | B元素的一种核素可用于考古时测定一些文物的年代 |
C | C 原子最外层电子总数是次外层电子总数的3倍 |
D | D 原子的2p能级处于半充满状态 |
E | E的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
(1)A元素基态原子的电子排布式为_______。
(2)B、C、D元素的第一电离能由大到小的顺序为______(填元素符号)。
(3)简单气态氢化物的热稳定性:C ____E(填“>”或“<”)。
(4)根据VSEPR模型预测D的氢化物的立体构型为______,中心原子D的杂化轨道类型为____;BD-中σ键与π键的数目之比为_________。
(5)足量D的氢化物水溶液与CuSO4溶液反应生成深蓝色的配离子,该配离子用结构示意图表示为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
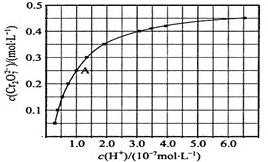
①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42的平衡转化率___________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的转化和重整受到越来越多的关注,它是有效应对全球气候变化、促进低碳社会构建的重要方法。
(1)热化学转化法。
CO2催化加氢合成CH4,其过程中主要发生下列反应:
反应Ⅰ:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
反应Ⅱ:CO(g)+H2O (g)=CO2(g)+H2(g);ΔH=+2.8 kJ·mol-1
反应Ⅲ:2CO(g)+O2(g)=2CO2(g);ΔH=-566.0 kJ·mol-1
则反应CO2(g)+4H2(g)=CH4(g)+2H2O(g) 的ΔH=________kJ·mol-1。
(2)CO2催化还原法。
图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当有1 mol CO2反应时,直接传递的电子物质的量为________mol。
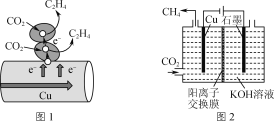
(3)CO2电化学催化重整法。
①图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为______________________,电解一段时间后,阳极区溶液pH减小,其原因是__________________。
②CO2与CH4在催化剂作用下合成乙酸,反应的化学方程式为________。
(4)CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。
①研究发现金属杂多酸盐中x对CO2转化率的影响如图3所示,由图3得出催化效果最好的金属杂多酸盐化学式是________。
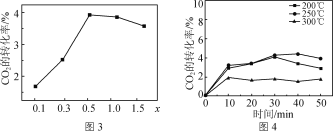
②催化剂在温度不同时对CO2转化率的影响如图4所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向 100mL0.01mol/LHA 溶液中逐滴加入 0.02mol/LMOH 溶液,混合溶液的pH 变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
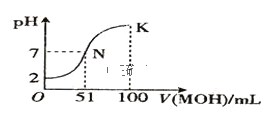
A.MA 溶液的 pH > 7
B.K 点时加水稀释溶液,c(H+)减小
C.在 N 点,c(A) = c(M+) + c(MOH)
D.在 K 点,c(M+) > c(A) > c(OH) > c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com