
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+、Cl-、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是
A.K+可能存在B.该溶液中含CO32-离子的浓度为0.2mol/L
C.Cl-一定不存在D.Ba2+一定不存在,Mg2+可能存在
【答案】B
【解析】
①第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生的离子有Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol,溶液中一定含有NH4+,并且物质的量为0.04mol;
③不溶于盐酸的2.33g为硫酸钡,物质的量为![]() =0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为
=0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为![]() =0.02mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+;正电荷为:n(+)=n(NH4+)=0.04mol;负电荷为:c(-)=2c(CO32-)+2c(SO42-)=0.06mol,正电荷总物质的量大于负电荷,由电荷守恒可知原溶液中一定有K+,至少为0.02mol;
=0.02mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+;正电荷为:n(+)=n(NH4+)=0.04mol;负电荷为:c(-)=2c(CO32-)+2c(SO42-)=0.06mol,正电荷总物质的量大于负电荷,由电荷守恒可知原溶液中一定有K+,至少为0.02mol;
综合以上可可知溶液中一定存在的离子有NH4+、K+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-。
A.由分析可知,原溶液中一定有K+,故A错误;
B. 由分析可知,溶液中含CO32-离子的物质的量为0.02mol,则浓度为![]() =0.2mol/L,故B正确;
=0.2mol/L,故B正确;
C. 由分析可知,原溶液中可能存在Cl-,故C错误;
D. 由分析可知,原溶液中一定存在CO32-、SO42-,则一定没有的离子Mg2+、Ba2+,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
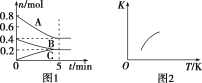
A.该反应可表示为2A(g)+B(g)![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套电化学装置,对其有关说法错误的是( )
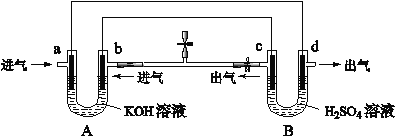
A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液pH增大
C.a若消耗1mol CH4,d可产生4mol气体
D.a通入C2H6时的电极反应为 C2H6-14e-+ 18OH-= 2CO32-+ 12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
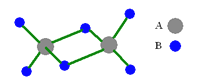
A.该化合物的化学式是Al2Cl6
B.该化合物在固态时所形成的晶体是分子晶体
C.该化合物是离子化合物,在熔融状态下能导电
D.该化合物中存在共价键,且不含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
A.4.1275 gB.4.255 gC.8.51 gD.9.62 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2S的燃烧热ΔH=-akJ·mol-1,写出表示H2S燃烧反应的热化学方程式__,表示H2S燃烧热的热化学方程式__。
(2)若将FeCl3溶液蒸干灼烧,最后得到的固体产物主要是__(填化学式)。FeCl3水溶液呈__(填“酸”、“中”、“碱”)性,原因为:__(用离子方程式表示)。
(3)炒过菜的铁锅未及时洗净(残液中有NaCl),第二天便会被腐蚀而出现红褐色铁锈,试回答:铁锅的腐蚀属于电化腐蚀,其原因是__。此时铁锅锈蚀主要是吸氧腐蚀,电极反应方程式为:负极:__,正极__。
(4)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
NH4NO3爆炸:2NH4NO3(s)=2N2(g)+4H2O(g)+O2(g)__
水煤气转化:CO(g)+H2O(g)=CO2(g)+H2(g)__
臭氧的生成:3O2(g)=2O3(g)__
A.熵增大 B.熵减小 C.熵变很小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___(填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___价;根据价层电子对互斥理论判断SO42-的空间构型为___。
(3)与N3-互为等电子体的分子有___(写两种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15:8,则A的摩尔质量为___。
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com