
已知N、P同属元素周期表的第ⅤA族元素,N在第二周期,P在第三周期,NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N—H键间的夹角是107.3°。
(1)PH3分子与NH3分子的构型关系是____________(填“相同”、“相似”或“不相似”)______________(填“有”或“无”)P—H键,PH3分子是______________(填“极性”或“非极性”)分子。
(2)NH3与PH3相比,热稳定性更强的是____________,原因是_____________。
(3)NH3和PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________________。
| A.键的极性N—H比P—H强 |
| B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 |
| D.NH3分子之间存在特殊的分子间作用力 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案科目:高中化学 来源: 题型:单选题
一定条件下,氨气和氟气发生反应:4NH3 + 3F2 → NF3 + 3NH4F,其中产物NF3分子结构和NH3相似。下列有关说法错误的是
| A.NF3分子呈三角锥形 |
| B.NF3分子是极性分子 |
| C.NF3与NH3晶体类型相同 |
| D.上述反应中,反应物和生成物均属于共价分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A.氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.氯化硼遇水蒸气会产生白雾 | D.氯化硼分子属极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ,Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。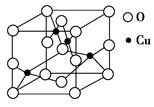
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: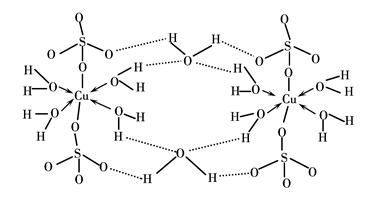
下列说法正确的是________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,N3-的电子排布式为________________。
(2)NN叁键的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1。计算说明N2中的________键比________键稳定(填“σ”或“π”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是 (填序号,下同),既存在离子键又存在极性键的是 。
(2)②号物质的电子式为 、用电子式表示⑥号物质的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中错误的是
| A.当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B.SO3为平面正三角形结构 |
| C.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
| D.配位数为4的配合物均为正四面体结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com