
下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:单选题
BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是
| A.分子中各原子最外层都满足8电子稳定结构 |
| B.键角均为60°,都是含有极性键的极性分子 |
| C.BF3沸点低于BCl3沸点,因为B-F键键长短 |
| D.BF3分子稳定性高于BCl3,因为B-F键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)有下列物质:①CO2 ②N2 ③H2O2 ④NH3 ⑤Ca(OH)2 ⑥Na2O2 ⑦NH4Cl,试用以上物质的序号填空:
(1)既有极性键,又有非极性键的是______________;
(2)既有离子键,又有非极性键的是______________;
(3)属于共价化合物的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)现有下列八种物质: HCl、NH4Cl、N2、Na2O2、CaCl2、Cl2、NaF、CO2
回答下列问题:
(1)只含有离子键的物质是 (填化学式,下同)。
(2)既含有离子键,又含有共价键的物质是 。
(3)属于共价化合物的是 ,其中所有原子都满足8电子结构的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为 。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为 。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 。
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为 (填序号)。
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知N、P同属元素周期表的第ⅤA族元素,N在第二周期,P在第三周期,NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N—H键间的夹角是107.3°。
(1)PH3分子与NH3分子的构型关系是____________(填“相同”、“相似”或“不相似”)______________(填“有”或“无”)P—H键,PH3分子是______________(填“极性”或“非极性”)分子。
(2)NH3与PH3相比,热稳定性更强的是____________,原因是_____________。
(3)NH3和PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________________。
| A.键的极性N—H比P—H强 |
| B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 |
| D.NH3分子之间存在特殊的分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)用电子式表示共价分子:H2________,N2________,CO2________,H2O________。
(2)用电子式表示下列共价分子的形成过程。
H2:_______________________________;
N2:________________________________;
H2O:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中H—N—H键角比NH3中H—N—H键角大,原因是__________________。
(2)Cu3N形成的晶体结构如图所示,N3-的配位数是________________。
(3)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有________,其大小顺序是__________。
(4)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )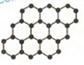
| A.石墨烯与石墨互为同位素 |
| B.0.12g石墨烯中含有6. 02×1022个碳原子 |
| C.石墨烯是一种有机物 |
| D.石墨烯中的碳原子间以共价键结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com