
【题目】根据问题填空:
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量). ①反应的热化学方程式为 .
②又已知H2O(l)═H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJmol﹣1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式: .
(3)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol﹣1 , 1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为kJ.
【答案】
(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣642kJ/mol;409;产物不会造成环境污染
(2)FeO(s)+CO(g)═Fe(s)+CO2(g)△H=﹣11 kJ?mol﹣1
(3)299
【解析】解:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.8KJ的热量,则1mol液态肼放出的热量为 ![]() =642kJ,
=642kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣642kJ/mol,所以答案是:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣642kJ/mol;
②N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣642kJ/mol①;H2O(l)=H2O(g)△H=+44kJ/mol②;依据盖斯定律①﹣②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣818KJ/mol:则16g液态肼物质的量= ![]() =0.5mol;与液态双氧水反应生成液态水时放出的热量409kJ;所以答案是:409;③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染;所以答案是:产物不会造成环境污染;(2)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=﹣25kJ/mol②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=﹣47kJ/mol③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol依据盖斯定律①×3﹣(③×2+②)得到:
=0.5mol;与液态双氧水反应生成液态水时放出的热量409kJ;所以答案是:409;③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染;所以答案是:产物不会造成环境污染;(2)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=﹣25kJ/mol②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=﹣47kJ/mol③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol依据盖斯定律①×3﹣(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=﹣66KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=﹣11KJ/mol,
所以答案是:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=﹣11KJ/mol;(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ﹣436kJ﹣151kJ=11kJ,解得x=299,所以答案是:299kJ.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( ) 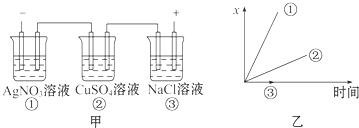
A.各电解池析出气体体积总数的变化
B.各电解池阳极质量的增加
C.各电解池阴极质量的增加
D.各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol丙烷共用电子对数为10 NA
B.0.5 mol甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA
C.标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为 ![]() NA
NA
D.1 mol甲醇与足量钠反应,转移电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏伽德罗常数,则关于热化学方程式:C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJmol﹣1的说法中,正确的是( )
O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJmol﹣1的说法中,正确的是( )
A.当有6 NA个电子转移时,该反应放出1300 kJ的能量
B.当有NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
D.2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃在酸性KMnO4溶液中双键断裂形式为: 
![]()
 现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为( )
现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为( )
A.(CH3)2C═C(CH3)CH2CH2CH═CH CH2CH3
B.(CH3)2C═CHCH2CH2C(CH3)═CHCH3
C.CH3CH═C(CH3)CH2CH2CH2C(CH3)═CH2
D.CH3CH═C(CH3)CH2CH2CH2CH═CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH ![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO ![]() 、SO
、SO ![]() 、SiO
、SiO ![]() 、NO
、NO ![]() 中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题: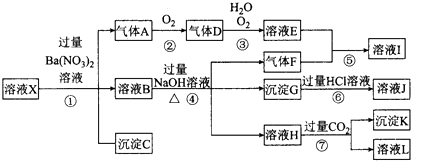
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 .
(2)溶液X中,关于N03﹣的判断一定正确的是 . a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 .
(4)转化⑥发生反应的现象为 .
(5)转化④中产生H的离子方程式为 .
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 ①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com