
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH ![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO ![]() 、SO
、SO ![]() 、SiO
、SiO ![]() 、NO
、NO ![]() 中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题: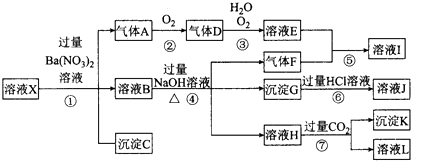
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 .
(2)溶液X中,关于N03﹣的判断一定正确的是 . a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 .
(4)转化⑥发生反应的现象为 .
(5)转化④中产生H的离子方程式为 .
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 ①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
【答案】
(1)CO32﹣、SiO32﹣
(2)B
(3)3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O
(4)红褐色沉淀溶解,溶液呈黄色
(5)Al3++4OH﹣=AlO2﹣+2H2O
(6)4:1
(7)②
【解析】解:某强酸性溶液X,则溶液中不存在弱酸根离子CO32﹣、SiO32﹣,溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42﹣,不存在和硫酸根离子反应的Ba2+,C是BaSO4;
酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3﹣不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3﹣,A是NO;
溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3;
A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3,(1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32﹣、SiO32﹣,
所以答案是:CO32﹣、SiO32﹣;(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3﹣,
故选b;(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,
所以答案是:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;(4)氢氧化铁和稀盐酸反应生成氯化铁和水,氢氧化铁为红褐色沉淀,氯化铁溶液呈黄色,所以看到的现象是:红褐色沉淀逐渐溶解,溶液变为黄色,
所以答案是:红褐色沉淀溶解,溶液呈黄色;(5)铝离子和过量氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al3++4OH﹣=AlO2﹣+2H2O,
所以答案是:Al3++4OH﹣=AlO2﹣+2H2O;(6)若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,该反应方程式为:NO2+2H2O+O2=4HNO3,则反应中D与O2的物质的量之比为4:1,
所以答案是:4:1.(7)溶液中Fe3+是否存在不能确定,Fe3+和硫氰化钾溶液反应生成血红色溶液,所以可以用硫氰化钾溶液检验,故选②;
所以答案是:②.


科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量). ①反应的热化学方程式为 .
②又已知H2O(l)═H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJmol﹣1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式: .
(3)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol﹣1 , 1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.若增大压强,则物质Y的转化率减小
B.将容器体积变为5 L,Z的平衡浓度变为原来的2倍
C.Y浓度变化表示的反应速率为0.0005 mol/(Ls )
D.若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径:
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是_________;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——______________;
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是_________
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比倡的熔点高 D.打磨砂纸不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验
生成的气体体,向反应后的溶液中加入酚酞试液,可以看到__________;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是__________,该反应每消耗1mol铁,转移电子的物质的量为_________。
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜也变化的原因是(用化学方程式表示):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
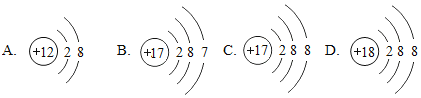
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
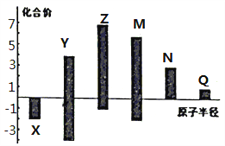
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类说法正确的是( )
A. 纯碱、液态氧、碘酒、稀盐酸依次是盐、单质、混合物、电解质
B. 干冰、生石灰、硫酸、碳酸氢铵依次是单质、氧化物、酸、盐
C. 氯化氢、氨气、水银、草木灰依次是电解质、非电解质、单质、混合物
D. 冰水、空气、泥水依次是溶液、胶体、浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.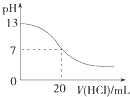 图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.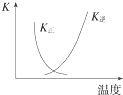 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.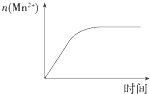 图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.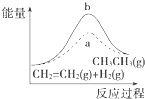 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.
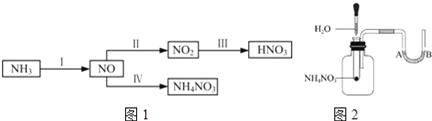
【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O
(1)如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因________.一段时间后还能观察到的现象是____________.
(2)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是______,能否用硝酸铵代替氯化铵,______(填“能”或“不能”),理由是______.
(3)从反应类型角度分析在I~IV的转化过程中的共同点是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com