
【题目】已知铍的原子半径为0.089 nm,下面是几种短周期元素的相关信息(该题中大写字母均为元素代号,不是元素符号)
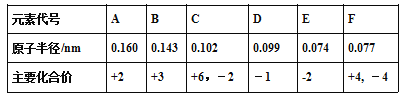
(1)C元素的简单阴离子结构示意图________,F元素在周期表中的位置____________。
(2)D的单质与水反应的离子方程式_____________,该反应生成的含氧酸的电子式________。
(3)F元素与半径最小的元素形成的最简单有机化合物的结构式___________。
(4)钠元素与E元素形成的所有化合物中,可能含有的化学键类型_______(填字母代号)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键
(5)B、C、E三种元素的简单离子半径由大到小顺序________________(填离子符号)。
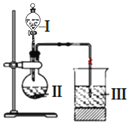
(6)某同学选取稀硫酸、过量碳酸氢钠溶液和过量硅酸钠溶液,并设计了下图装置完成硫、碳、硅三种元素非金属性强弱比较的实验研究。下图中装置Ⅰ的名称_______,装置Ⅲ中反应的离子方程式_________________。
【答案】 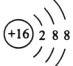 第二周期第ⅣA族
第二周期第ⅣA族 ![]() Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO 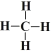 ac S2-> O2-> Al3+ 分液漏斗 SiO32- + H2O + CO2 = CO32- +H2SiO3↓
ac S2-> O2-> Al3+ 分液漏斗 SiO32- + H2O + CO2 = CO32- +H2SiO3↓
【解析】F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径大于氧,则D为Cl;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al;F的原子径略大于E,且最高价为+4价,则F应为C元素;
(1)C为S元素,S2-离子结构示意图为 ,F为C元素,在周期表中的位置第二周期第ⅣA族;
,F为C元素,在周期表中的位置第二周期第ⅣA族;
(2)Cl2与水反应生成的HClO为弱酸,其反应的离子方程式为Cl2+H2O=H++Cl-+HClO,该反应生成的含氧酸HClO的电子式为![]() ;
;
(3)C元素与H元素形成的最简单有机化合物为CH4,其结构式为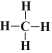 ;
;
(4)钠元素与氧元素形成的离子化合物有Na2O、Na2O2,含有的化学键类型有离子键、非极性共价键,故答案为a、c;
(5)O2-、Al3+离子结构相同,核电荷数越大离子半径越小,而S2-比前二者均多一个电子层,离子半径最大,则三种简单离子半径由大到小顺序为S2-> O2-> Al3+;
(6)依据仪器的结构,装置Ⅰ为分液漏斗;根据反应原理可知,装置Ⅲ中是硅酸钠溶液中通入CO2气体,有白色沉淀生成,发生反应的离子方程式为SiO32- + H2O + CO2 = CO32- +H2SiO3↓。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:
利用如图装置测定化学反应速率(已知:S2O32-+2H+═H2O+S↓+SO2↑)

(1)除如图装置所示的实验用品外,还需要的一种实验用品是________。
A.温度计 B.秒表 C.酒精灯
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__________。
实验二:
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(3)表中Vx=____mL,t1、t2、t3的大小关系是________。
实验三:
取5mL0.1mol/L的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液溶液2mL,发生如下反应:2Fe3++2I-==2Fe2++I2.为证明该反应达到一定可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色(AgI)沉淀;
②再取少量反应液,滴加少量CCl4,振荡,发现CCl4层显浅紫色.
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度.
(4)指导老师指出他们上述实验中①不合理,你认为其原因是___________ ;改进的方法是__________ 。
(5)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

下列说法不正确的是
A. 在海水中加入石灰乳的作用是沉淀Mg2+
B. 可用电解氯化镁的方法获得镁
C. 操作B涉及到加热浓缩(或蒸发结晶)、过滤等操作
D. 上述过程中只涉及到氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物。关于乙醇和乙酸的说法不正确的是
A. 两者互为同分异构体B. 沸点都比C2 H6的沸点高
C. 两者之间能发生酯化反应D. 两者均是某些调味品的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 1 mol KClO3所含有的氧原子数为NA
B. 标准状况下,22.4 L水中含有的水分子数为NA
C. 标准状况下,22.4 L NH3所含的分子数为NA
D. 1L 0.2 mol/L KC1溶液中所含的K+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__(填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____。1 mol HCHO分子中含有σ键的物质的量为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__。与H2O分子互为等电子体的阴离子为__。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________。
(2)元素B、C、D的第一电离能由小到大排列顺序为________。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com