
| 充电 |
| 放电 |


科目:高中化学 来源: 题型:
| A、Ca2+、Cl-、CO32- |
| B、K+、Na+、SO42- |
| C、HCO3-、Na+、OH- |
| D、K+、Fe3+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
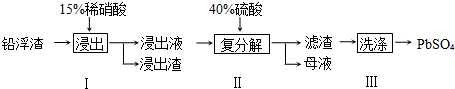
 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易溶于水的固体物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相容的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
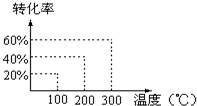 将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )
将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )| A、100℃ | B、200℃ |
| C、300℃ | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 |
| B、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C、焰色反应每次实验都要先用稀硫酸洗净铂丝 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com