
| A、蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 |
| B、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C、焰色反应每次实验都要先用稀硫酸洗净铂丝 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(H+) | ||
| B、c(H+)?c(OH-) | ||
| C、C(OH-) | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氢气 |
| B、粗盐提纯 |
| C、分离苯和水的混合物 |
| D、用氯化钠晶体配制100g 5%的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
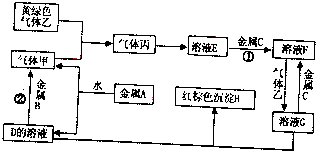
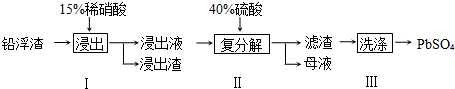
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、①②④⑤ |
| C、除⑥外 | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡常数均无单位 |
| B、平衡常数越大则转化率越大 |
| C、对于一个化学计量数固定的反应,平衡常数的大小只与温度有关 |
| D、在平衡常数表达式中,反应物的浓度为初始浓度,生成物的浓度为平衡浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
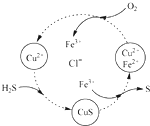 完成下列各小题的计算
完成下列各小题的计算查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com