
| A、Ca2+、Cl-、CO32- |
| B、K+、Na+、SO42- |
| C、HCO3-、Na+、OH- |
| D、K+、Fe3+、SCN- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
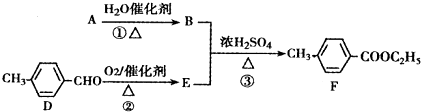
查看答案和解析>>
科目:高中化学 来源: 题型:
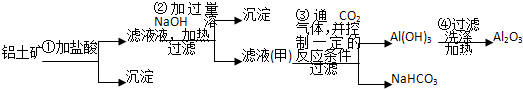
查看答案和解析>>
科目:高中化学 来源: 题型:
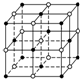 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.
地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
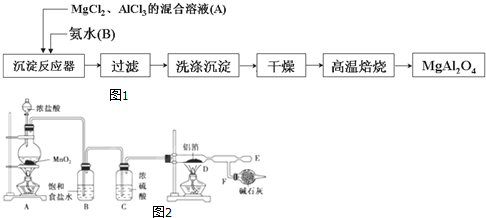
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与足量水反应并加热,收集到标准状况下V1L干燥气体 |
| B、与足量稀盐酸反应并蒸干,称量剩余固体质量m1g |
| C、隔绝空气加热,冷却后,称量剩余固体质量m2g |
| D、溶于足量水,滴入足量氯化钙溶液,过滤、洗涤、干燥、称重质量为m3g |
查看答案和解析>>
科目:高中化学 来源: 题型:
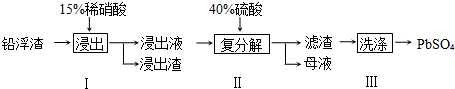
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(H+) | ||
| B、c(H+)?c(OH-) | ||
| C、C(OH-) | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com