

 ,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为:
,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为: ;S=C=S;
;S=C=S;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
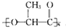 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是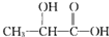 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为NaCl晶体的晶胞示意图.
如图所示为NaCl晶体的晶胞示意图. 查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:NH3>AsH3>PH3 |
| B、熔点:MgCl2>SiO2>CO2 |
| C、酸性:H3PO4>H2SO4>HClO4 |
| D、碱性:LiOH>NaOH>KOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com