
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 0.73g |
| 36.5g/mol |


科目:高中化学 来源: 题型:
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 分子内的作用力有
分子内的作用力有 ④HCHO等,其中分子属于平面结构的有
④HCHO等,其中分子属于平面结构的有 中C的杂化方式为
中C的杂化方式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| k1 |
| k2 |

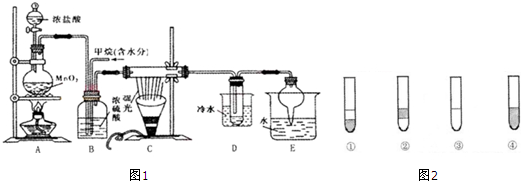
| 沸点 | 水溶性 | |
| 甲醇 | 65℃ | 与水相溶 |
| 甲醛 | -21℃ | 与水相溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH3分子呈三角锥形 |
| B、PH3分子是极性分子 |
| C、PH3分子中所有原子最外层都满足8e-结构 |
| D、PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com