
����Ŀ��ij�о���ѧϰС���ͬѧΪ��ʵ�������ֶ�������������Ĺ��̣�����ȡ�������������壬�������ͼ��ʾ��װ�á���֪����������ˮ�������Ტ�ų������ȣ������γ��������Իش�
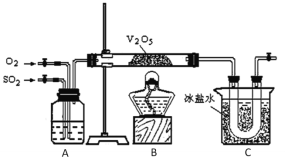
��1����֪450��ʱ����Ӧ2SO2(g)��O2(g)![]() 2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)
2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)![]() 2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
��2��A�е��Լ���___��
��3����ʵ������в��س������ȣ�˵����ƽ��ġ�H___0������>��������������<����,Cװ�������ռ������������б���ˮ��������___������32gͭ������Ũ���ᷴӦ��ȡ��������ʵ�����ʱ�õ�20g��������ʵ���ж��������ת���ʲ�С��___��
��4����ָ������ʵ��װ�õ�����ȱ���ǣ�___��
���𰸡�0.04 ŨH2SO4 �� ��ȴSO3�Եõ����� 50% ȱ��β������װ��
��������
(1)��ͬ�����£����淴Ӧ�Ļ�ѧƽ�ⳣ����Ϊ�������ݴ˷������㣻
(2)����ͼʾ������Ӳ�ʲ����ܵ�������Ҫ����ݴ˷����жϣ�
(3)��ʵ������в��س������ȣ�˵���÷�ӦΪ���ȷ�Ӧ���������������۷е�������32gͭ�����ʵ���=![]() =0.5mol������2H2SO4(Ũ) + Cu
=0.5mol������2H2SO4(Ũ) + Cu![]() CuSO4 + 2H2O +SO2�����������ϵõ������������ټ�����������ת���ʣ�
CuSO4 + 2H2O +SO2�����������ϵõ������������ټ�����������ת���ʣ�
(4)�÷�ӦΪ���淴Ӧ��β����һ�����ж������ݴ˷������
(1)��ͬ�����£����淴Ӧ�Ļ�ѧƽ�ⳣ����Ϊ�����������450��ʱ��2SO3(g)![]() 2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��=
2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��=![]() =0.04���ʴ�Ϊ��0.04��
=0.04���ʴ�Ϊ��0.04��
(2)����ͼʾ������Ӳ�ʲ����ܵ�������Ҫ������A�е��Լ�ΪŨ���ᣬ�ʴ�Ϊ��ŨH2SO4��
(3)��ʵ������в��س������ȣ�˵���÷�ӦΪ���ȷ�Ӧ����H��0��Cװ�������ռ������������б���ˮ������ȴSO3�Եõ����������壻32gͭ�����ʵ���=![]() =0.5mol������2H2SO4(Ũ) + Cu
=0.5mol������2H2SO4(Ũ) + Cu![]() CuSO4 + 2H2O +SO2����֪�������ϸ�����Ũ���ᷴӦ��������0.5mol������������ȫת�����ܹ��õ�0.5mol�����������ʵ���ж��������ת���ʲ�С��
CuSO4 + 2H2O +SO2����֪�������ϸ�����Ũ���ᷴӦ��������0.5mol������������ȫת�����ܹ��õ�0.5mol�����������ʵ���ж��������ת���ʲ�С��![]() ��100%=50%���ʴ�Ϊ��������ȴSO3�Եõ����壻50%��
��100%=50%���ʴ�Ϊ��������ȴSO3�Եõ����壻50%��
(4)�÷�ӦΪ���淴Ӧ��β����һ�����ж���������Ⱦ�������ʴ�Ϊ��ȱ��β������װ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����1 L���ܱ������г���2 mol CO2��6mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=��49.0kJ/mol�����H2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ������˵������ȷ���� �� ��
CH3OH(g)+H2O(g) ��H=��49.0kJ/mol�����H2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ������˵������ȷ���� �� ��
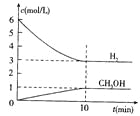
A.0~10min��v(H2)=0.3mol/(L��min)
B.T��ʱ��ƽ�ⳣ��K=![]() ��CO2��H2��ת�������
��CO2��H2��ת�������
C.T��ʱ��������Ӧ����64g CH3OH���ɣ�ͬʱ�ų�98.0kJ������
D.�ﵽƽ��������¶Ȼ��ٳ���CO2���壬���������H2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��·�Ӧ4A(s)+3B(g)2C(g)+D(g)��2min B��Ũ�ȼ���0.6molL-1���Դ˷�Ӧ���ʵı�ʾ��ȷ����( )
A.��A��ʾ�ķ�Ӧ������0.4molL-1min-1
B.�ֱ���B��C��D��ʾ��Ӧ�����ʣ����ֵ��1��2��3
C.2minĩ�ķ�Ӧ����v(B)=0.3molL-1min-1
D.��2min����B��C��ʾ������Ӧ���ʵ�ֵ������С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����CO2�ŷ���һ����Ҫ���⡣CO2��������������ɵ�̼�л����Ҫ�����·�Ӧ��
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H1����49.6kJ/mol
��Ӧ��CH3OCH3(g)��H2O(g) 2CH3OH(g) ��H2����23.4kJ/mol
��Ӧ��2CO2(g)��6H2(g) CH3OCH3(g)��3H2O(g) ��H3
(1)��H3��__________kJ/mol��
(2)���º��������£����ܱ�������ͨ������ʵ�����CO2��H2��������Ӧ������������˵����Ӧ��ﵽƽ��״̬����_____________(�����).
A.��Ӧ��ϵ��ѹǿ���ֲ���
B.�����ڵĻ��������ܶȱ��ֲ���
C.ˮ�����ж���2NA��H��O����ͬʱ������ж���3NA��H��H��
D.CH3OH��H2O��Ũ��֮�ȱ��ֲ���
(3)��Ӧ����ij�¶��µ�ƽ�ⳣ��Ϊ0.25�����¶��£����ܱ������м�������ʵ�����CH3OCH3(g)��H2O(g)����Ӧ��ijʱ�̲�ø����Ũ�����£�

��ʱ��v��_________v�� (����>������<����������)������Ӧ�ﵽƽ��ʱ�����������CH3OH�������(CH3OH)%��_________%��
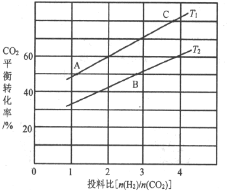
(4)��ӦIII�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12 mol H2����2L���ܱ������У�5 min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3)=________��ƽ�ⳣ��K=_____������С�����һλ����KA��KB��KC����֮����ɴ�С��ϵΪ______��
(5)��ѹ�½�CO2��H2�������1��3��ϣ��ڲ�ͬ���������·�����Ӧ��ͷ�Ӧ������ͬ��ʱ�����CH3OH��ѡ���ԺͲ������¶ȵı仯����ͼ�����У�CH3OH��ѡ���ԣ�![]() ��100��
��100��
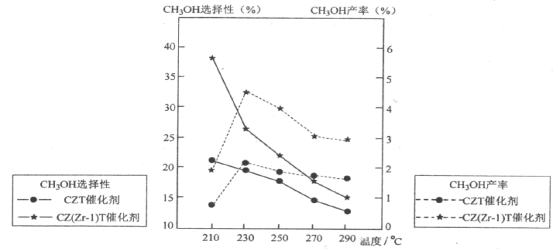
���¶ȸ���230��C��CH3OH�������¶����߶��½���ԭ����_______________������һ�����ɣ�
�������������ºϳɼ״��Ĺ�ҵ������___________________��
A.210��C B.230��C C.����CZT D.����CZ(Zr��1)T
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������һ�����ܱ������и�������A��B��C��������һ�������·�����Ӧ�����Ļ�ѧƽ�⣺aA��g��+bB��g��xC��g����������ͼ��ʾ�Ĺ�ϵ��C%��ʾƽ�������в���C�İٷֺ�����T��ʾ�¶ȣ�p��ʾѹǿ������ͼ�У�Y����ָ��������
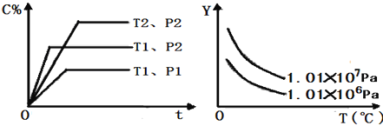
A.��Ӧ��A�İٷֺ���B.ƽ��������������B�İٷֺ���
C.ƽ����������ܶ�D.ƽ���������ƽ��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2 ��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ�һ������NaClO2 �Ĺ������£�
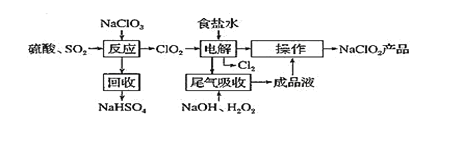
��֪����ClO2��һ��ǿ���������壬Ũ�ȴ�ʱ�ֽⱬը��������ʹ��ʱҪ��ϡ�����������Ƚ���ϡ�ͣ�ͬʱ������ա��ȡ���NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��33H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl���ش��������⣺
(1)�����ѧ����������Ӧ������Ļ������о�����H2C2O4����SO2�Ʊ�ClO2���·������÷����Ļ�ѧ����ʽΪ______________________��
(2)��ò�ƷNaClO2�����������������²��裺
����ѹ��55�������ᾧ�������ȹ��ˣ���___________________________������60������õ���Ʒ��
(3)Ϊ�˲ⶨ��ƷNaClO2�Ĵ��ȣ�ȡ�������ò�Ʒ12.5g����ˮ���1L��Һ��ȡ��10.00mL��Һ����ƿ�У��ټ��������ữ��KI��Һ����ַ�Ӧ��(ClO2������ԭΪCl�����ʲ��μӷ�Ӧ)������2~3�ε�����Һ����0.25molL��1Na2S2O3��Һ�ζ����ﵽ�ζ��յ�ʱ��ȥ��Һ20.00mL���Լ����ƷNaClO2�Ĵ���_________________________(��ʾ��2Na2S2O3+I2=Na2S4O6+2NaI)

(4)NaClO2��Һ�д���ClO2��HClO2��ClO2����Cl�����ֺ����������ⶨ 25����������Ũ���� pH �ı仯�����ͼ��ʾ(Cl��û�л���)
������������NaClO2��Һ�д���Cl����ԭ����_______________________(�����ӷ���ʽ����)��
��pH=5ʱ��NaClO2��Һ��ClO2��HClO2��ClO2����Cl�����ֺ�������Ũ���ɴ�С��˳����___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ��Ԫ���ᣬ
Ϊ��Ԫ���ᣬ![]() ��
��![]() ����
����![]() ��Һ��
��Һ��![]() ����������NaOH��Һ�ζ�
����������NaOH��Һ�ζ�![]() ��Һ���յ㡣�ζ����̵õ���������Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����( )
��Һ���յ㡣�ζ����̵õ���������Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����( )
A.![]() ��Һ��
��Һ��![]()
B.![]() ����Һ��
����Һ��![]()
C.![]() ����Һ��
����Һ��![]()
D.![]() ����Һ��
����Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϵ�У����ӿ��ܴ����������![]()
A.�μ�KSCN�Ժ�ɫ����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
B.�����£�ˮ�������![]() ����Һ��
����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
C.ʹ��̪�Լ��Ժ�ɫ����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
D.����Al�ܲ���![]() ����Һ��
����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com