
【题目】下列体系中,离子可能大量共存的是![]()
A.滴加KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.常温下,水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.使酚酞试剂显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.加入Al能产生![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
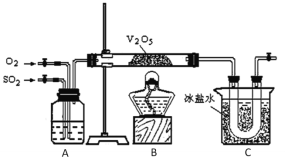
(1)已知450℃时,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)
2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)![]() 2SO2(g)+O2(g)的化学平衡常数为___。
2SO2(g)+O2(g)的化学平衡常数为___。
(2)A中的试剂是___。
(3)在实验过程中不必持续加热,说明该平衡的△H___0(填“>”或“=”或“<”),C装置用来收集三氧化硫,其中冰盐水的作用是___;若用32g铜跟足量浓硫酸反应制取二氧化硫,实验结束时得到20g三氧化硫,该实验中二氧化硫的转化率不小于___。
(4)请指出本套实验装置的明显缺陷是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
(1)该反应的平衡常数的表达式为_________________;升高温度,K值将________;容器中气体的平均相对分子质量将________。(填“增大”、“减小”或“不变”)。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡将________(填字母)。
A.向左移 B.向右移 C.不移动
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有________(填字母)。
A.单位体积内每消耗1 mol CO的同时生成1 mol H2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+H2O(g)![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释或结论中,错误的是![]()
A.利用NaOH溶液除去金属铝表面的氧化膜:![]()
B.NaCl溶液与![]() 溶液均呈中性,说明两溶液中水的电离程度相同
溶液均呈中性,说明两溶液中水的电离程度相同
C.1mol某醇与足量的钠反应生成![]() 氢气
氢气![]() 标况下
标况下![]() ,该醇为二元醇
,该醇为二元醇
D.向KI溶液中滴加氯水和![]() ,振荡,静置后溶液出现分层且下层显紫色,证明
,振荡,静置后溶液出现分层且下层显紫色,证明![]() 氧化性强于
氧化性强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.用![]() 溶液和
溶液和![]() 溶液反应制取
溶液反应制取![]() 固体
固体
B.加热蒸发![]() 溶液制取
溶液制取![]() 固体
固体
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多
D.镀层破损后,镀锡铁板比镀锌铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类的水解有关的是![]()
①明矾和![]() 可作净水剂;
可作净水剂;
②实验室盛放![]() 、
、![]() 等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
③长期施用硫酸铵,土壤酸性增强;
④![]() 与
与![]() 溶液可作焊接中的除锈剂;
溶液可作焊接中的除锈剂;
⑤草木灰与铵态氮肥不能混合施用;
⑥用![]() 与
与![]() 两种溶液可作泡沫灭火剂。
两种溶液可作泡沫灭火剂。
A.①④B.②⑥C.③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积pH=2的NaHSO4溶液中,逐滴加入一定物质的量浓度的Ba(OH)2溶液,当溶液中的硫酸根恰好完全沉淀时,溶液的pH=11,若反应后溶液的体积等于反应的两溶液的体积之和,则NaHSO4溶液与Ba(OH)2溶液的体积比为
A.1:9B.1:1C.1:2D.1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com