
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
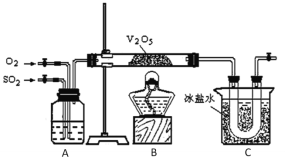
(1)已知450℃时,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)
2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)![]() 2SO2(g)+O2(g)的化学平衡常数为___。
2SO2(g)+O2(g)的化学平衡常数为___。
(2)A中的试剂是___。
(3)在实验过程中不必持续加热,说明该平衡的△H___0(填“>”或“=”或“<”),C装置用来收集三氧化硫,其中冰盐水的作用是___;若用32g铜跟足量浓硫酸反应制取二氧化硫,实验结束时得到20g三氧化硫,该实验中二氧化硫的转化率不小于___。
(4)请指出本套实验装置的明显缺陷是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
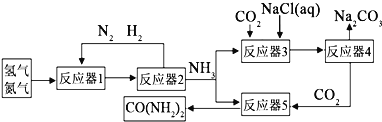
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:
![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl-
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++ SO![]() = BaSO4↓
= BaSO4↓
C.浓硫酸与铜反应:Cu+2H+= Cu2++H2↑
D.石灰石与稀醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
(1)该反应的平衡常数的表达式为_________________;升高温度,K值将________;容器中气体的平均相对分子质量将________。(填“增大”、“减小”或“不变”)。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡将________(填字母)。
A.向左移 B.向右移 C.不移动
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有________(填字母)。
A.单位体积内每消耗1 mol CO的同时生成1 mol H2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+H2O(g)![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释或结论中,错误的是![]()
A.利用NaOH溶液除去金属铝表面的氧化膜:![]()
B.NaCl溶液与![]() 溶液均呈中性,说明两溶液中水的电离程度相同
溶液均呈中性,说明两溶液中水的电离程度相同
C.1mol某醇与足量的钠反应生成![]() 氢气
氢气![]() 标况下
标况下![]() ,该醇为二元醇
,该醇为二元醇
D.向KI溶液中滴加氯水和![]() ,振荡,静置后溶液出现分层且下层显紫色,证明
,振荡,静置后溶液出现分层且下层显紫色,证明![]() 氧化性强于
氧化性强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com