
【题目】常温下,在10 mL 0.1 molL-1Na2CO3溶液中逐滴加入0.1 molL-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2 因逸出未画出,忽略因气体遭出而引起的溶液体积变化),下列说法正确的是
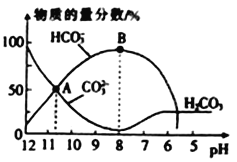
A. A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-)
B. 在B点所示的溶液中,浓度最大的离子是HCO3-
C. 当熔液的pH 为7时,溶液中的阴离子只有两种
D. 已知25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-)
【答案】D
【解析】A、根据电荷守恒,有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),故A错误;B、B点溶液显碱性,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),因为c(H+)较小,因此离子浓度最大的是Na+,故B错误;C、根据图像,溶液pH=7时,存在的阴离子有Cl-、HCO3-,以及HCO3-电离出少量的CO32-,故C错误;D、HCO3-的电离平衡常数Ka=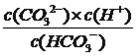 =5×10-11,当pH=10,此时溶液c(H+)=10-10mol·L-1,c(HCO3-)=2c(CO32-),故D正确。
=5×10-11,当pH=10,此时溶液c(H+)=10-10mol·L-1,c(HCO3-)=2c(CO32-),故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置 | ① | ② | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | ②出现红棕色气体 | 硝酸与铜生成了NO2③中需要碱溶液吸收尾气 |
B | 底端灼热的碳棒 | 浓硝酸 | ②中出现红棕色气体 | 产生气体一定是混合气体 | |
C | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液发生置换反应 | |
D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应式为2CH2===CH2+O2===2CH3CHO。下列有关说法正确的是
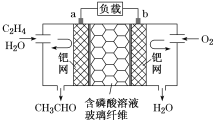
A. 每有0.1 mol O2反应,则迁移H+0.4 mol
B. 负极反应式为CH2===CH2-2e-+H2O===CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草药中有一种色素A,它的结构简式为![]() ,用它制成的试剂以检验物质的
,用它制成的试剂以检验物质的
酸碱性。能够跟1molA起反应的Br2(水溶液)或H2的最大用量分别是 ( )
A. 3 mol、5 mol B. 6 mol、8 mol C. 10 mol、8 mol D. 6 mol、10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
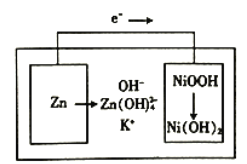
A. 放电时溶液中的K+移向负极 B. 充电时阴极附迁的pH会降低
C. 理论上负极质量每减少6.5g,溶液质量增加6.3g D. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如图所示。
![]()
(1)已知AlCl3的熔点为190℃,沸点为178℃,在湖湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。

①写出圆底烧瓶中发生反应的离子方程式:_________________。
②按气流方向连接各仪器接口,顺序为a→__________b→c→_______。 (填接口字母)
③装置F中应盛装的试剂是__________,装置D的作用是______________。
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是______________。
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化的与水反应的化学方程式为______________。
②设计如下四种装置测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是___(填编号)。

③某同学选用上述最恰当的裴置,称取mg铝氢化钠样品,测得生成气体的体积为VL(已折算为标准状况),重复实验操作三次,测得有关数据如下表所示,则样品中铝氢化钠的纯度为____。
实验次数 | 样品质量m(g) | 气体休积V(L) |
I | 1.20 | 1.907 |
II | 1.20 | 1.904 |
III | 1.20 | 1,901 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________________________。
(2)已知在一定温度下,①C(s)+CO2(g)![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:_____________,△H3=__________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的平衡转化率为:______________。
(4)在催化剂存在条件下反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;
CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;

对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP的表达式:KP=____________,提高p[H2O(g)]/p(CO)比,则KP__________(填“变大”、“变小”或“不变”)。实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、p[H2O(g)]/p(CO)=3~5。其原因可能是_________________________________。
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如上右图所示,请写出负极的电极反应式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离常数K=1.6×10-5,1g4=0.6。该温度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
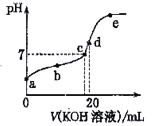
A. 滴定过程中宜选用甲基橙作指示剂
B. a点溶液中c(H+)为1×10-4 mol·L-1
C. a、b、c、d、e四点中水的电离程度最大的是e点
D. d 点时溶质的水解常数为6.25×10-10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com