
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________________________。
(2)已知在一定温度下,①C(s)+CO2(g)![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:_____________,△H3=__________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的平衡转化率为:______________。
(4)在催化剂存在条件下反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;
CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;

对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP的表达式:KP=____________,提高p[H2O(g)]/p(CO)比,则KP__________(填“变大”、“变小”或“不变”)。实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、p[H2O(g)]/p(CO)=3~5。其原因可能是_________________________________。
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如上右图所示,请写出负极的电极反应式:___________________________________。
【答案】 CO(g)+H2(g)![]() H2O(g) +C(s) K3= K1·K2 (a+b) kJ/mol 放热 75%
H2O(g) +C(s) K3= K1·K2 (a+b) kJ/mol 放热 75% ![]() 不变 该温度下催化剂活性最大;该压强比下,反应物转化率已经接近98% CO-2e-+CO32-=2CO2
不变 该温度下催化剂活性最大;该压强比下,反应物转化率已经接近98% CO-2e-+CO32-=2CO2
【解析】(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,根据K=c(H2O)/[ c(CO)·c(H2),所以该反应的方程式为CO(g)+H2(g)C(s)+H2O(g);
(2)根据化学方程式可知:K1=![]() ,K2=
,K2=![]() ,
,
K3=![]() ,所以:K3=K1·K2;
,所以:K3=K1·K2;
由①+②可得方程式C(s)+H2O(g)CO(g)+H2(g),所以△H3=(a+b)kJ/mol;
(3)由图可知温度越高K值越小,说明正反应为放热反应,

所以![]() =9,解得c=0.015,所以CO的转化率为
=9,解得c=0.015,所以CO的转化率为![]() ×100%=75%。
×100%=75%。
(4)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度也可以表示平衡常数(记作KP),反应的平衡常数![]() ;平衡常数只与温度有关,与浓度无关,所以提高
;平衡常数只与温度有关,与浓度无关,所以提高![]() 比,则KP不变;由图象可以知道,投料比太低,CO的转化率不太高,而投料比
比,则KP不变;由图象可以知道,投料比太低,CO的转化率不太高,而投料比![]() 时转化率已经很高达到
时转化率已经很高达到![]() ,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400
,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400![]() 左右,所以一般采用400
左右,所以一般采用400![]() 左右,H2O(气)
左右,H2O(气)![]() ;因此,本题正确答案是:
;因此,本题正确答案是:![]() ;不变;投料比太低,CO的转化率不太高,而投料比
;不变;投料比太低,CO的转化率不太高,而投料比![]() 时转化率已经很高达到
时转化率已经很高达到![]() ,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400
,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400![]() 左右;
左右;
(5)负极发生氧化反应,![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ),
),
点睛:(1)根据平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,据此分析解题;(2)根据平衡常数的表达式推断;应用盖斯定律来求△H3;(3)根据平衡常数随温度的变化来判断正反应方向是吸热还是放热,可以应用三段式结合平衡常数来求转化率。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15g A完全燃烧生成22g CO2和9gH2O。
(1)该有机物的最简式是___________________。
(2)若A是一种无色具存强烈剌激性气味的气体,具有还原性,则其结构简式是_________。
(3)A中只有一种官能团,若A和Na2CO3混合有气体放出,和醇能发生酯化反应,则A的结构简式为___________________。
(4)A中只有一种宫能团,若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为___________________。
(5)若A其分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 molL-1Na2CO3溶液中逐滴加入0.1 molL-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2 因逸出未画出,忽略因气体遭出而引起的溶液体积变化),下列说法正确的是
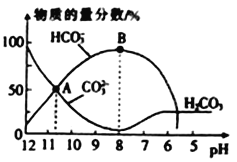
A. A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-)
B. 在B点所示的溶液中,浓度最大的离子是HCO3-
C. 当熔液的pH 为7时,溶液中的阴离子只有两种
D. 已知25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间
B. 化学反应达到最大限度时,正逆反应速率也达到最大且相等
C. 增加固体反应物的量可以加快反应速率
D. 用铁片和稀硫酸反应制H2比用的浓硫酸产生H2的速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,人们生活水平的提高和对环境要求的加强,来源广泛的高氨氮废水(主要含有NH4+)处理越来越受到重视。对于高氨氮废水的处理有多种方法。
(1)吹脱法:
![]()
使用吹脱法时需要在①中加入碱,写出发生的离子反应方程式______________________。
(2)MAP沉淀法:
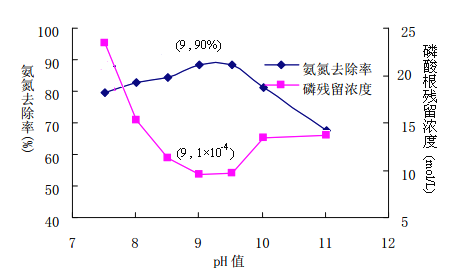
①使用化学沉淀剂处理高氨氮废水时,向高氨氮废水中投入含有Mg2+的物质和H3PO4,调节溶液pH,与NH4+反应生成MgNH4PO4(MAP)沉淀。为有效控制溶液PH,并考虑污水处理效果,则最好选用下列物质中_____。
A MgO B MgSO4 C MgCl2
②控制溶液PH的合理范围为____________________
③从溶解平衡角度解释PH过高或过低不易形成沉淀MAP的原因(已知PO43-在酸性较强条件下以HPO42-形式存在)_______________
(3)生物脱氮传统工艺:
①在有氧气的条件下,借助于好氧微生物(主要是好氧菌)的作用生成NO3-,写出反应的离子方程式_________________________。
②在无氧的酸性条件下,利用厌氧微生物(反硝化菌)的作用使NO3-与甲醇作用生成N2,达到净化水的目的。写出离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按系统命名法填写下列有机物的名称及有关内容:
(1)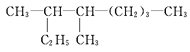 的名称是________________
的名称是________________
(2)2,6-二甲基-4-乙基辛烷的结构简式是________________________,1 mol该烃完全燃烧需要消耗氧气________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 10mL0.1mol·L-1醋酸中加入几滴1mol·L-1H2SO4后,c(CH3COOH)/c(H+)增大
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混合,所得混合液的pH=11,则H2SO4溶液与NaOH溶液的体积比9:1
C. 90℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
D. 0.5mol·L-1的下列溶液①NH3·H2O ②NH4Cl ③NH4HCO3 ④(NH4)2SO4,NH4+物质的量浓度大小关系:④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com