
【题目】室温时,向20mL0.1mol·L-1的醋酸溶液中不断滴加0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中微粒浓度大小关系的描述不正确的是( )

A.a点时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点时:c(Na+)>c(CH3COO-)
C.c点时:c(OH-)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
【答案】B
【解析】
A.a点溶质为等物质的量浓度的CH3COOH、CH3COONa,溶液pH<7,溶液呈酸性,则c(H+)>c(OH),溶液中存在电荷守恒c(CH3COO)+c(OH)=c(Na+)+c(H+),所以c(CH3COO)>c(Na+),但是醋酸电离和醋酸钠水解程度都较小,所以存在:c(CH3COO)>c(Na+)>c(H+)>c(OH),故A正确;
B.b点溶液呈中性,则c(H+)=c(OH),溶液中存在电荷守恒c(CH3COO)+c(OH)=c(Na+)+c(H+),所以c(CH3COO)=c(Na+),故B错误;
C.c点溶质为醋酸钠,溶液中存在电荷守恒c(CH3COO)+c(OH)=c(Na+)+c(H+),存在物料守恒c(CH3COO)+c(CH3COOH)=c(Na+),所以存在c(OH)=c(CH3COOH)+c(H+),故C正确;
D.d点溶质为等物质的量浓度的CH3COONa、NaOH,溶液的pH>7,溶液呈碱性,NaOH电离、CH3COONa水解都生成OH,只有CH3COONa电离生成CH3COO,所以c(OH)>c(CH3COO),结合物料守恒得c(Na+)>c(OH),所以存在c(Na+)>c(OH)>c(CH3COO)>c(H+),故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学根据下列仪器设计实验装置证明上述结论。请按要求回答问题。

(1)U形接管中所盛试剂的化学式为_______________。
(2)检验产物中HCl 的离子方程式:____________________。
(3)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在________________之间(填装置序号)瓶中可以放入_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到目的的是( )
A.装置①验证温度对反应2NO2(g)N2O4(g)平衡移动的影响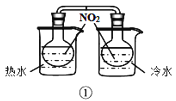
B.装置②验证增大反应物浓度对平衡的影响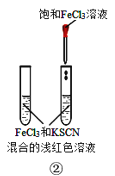
C.装置③测定中和热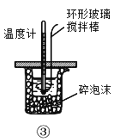
D.装置④比较Cu2+、Fe3+对H2O2分解速率的影响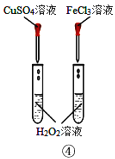
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
B.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
C.由C(s)+![]() O2(g)=CO(g)ΔH=+110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
O2(g)=CO(g)ΔH=+110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
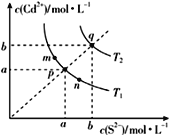
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向n点的溶液中加入少量CdCl2固体,溶液组成由n沿npm线向m方向移动
D.温度升高时,p点的饱和溶液的组成由p沿pq线向q方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746kJ/mol
反应Ⅱ:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H=-1200kJ/mol
则反应NO2(g) + CO(g) CO2(g) + NO(g)的△H=_____________kJ/mol。
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1mol CO和0.5mol SO2发生反应:2CO(g)+ SO2(g) 2CO2(g)+S(g)。实验测得生成的CO2的体积分数(ψ)随着时间的变化曲线如图所示:
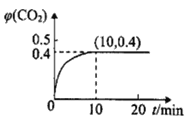
①达到平衡时,SO2的转化率为_____________。
②该温度下反应的平衡常数K=______________。
③其它条件保持不变,再向上述平衡体系中充入CO(g)、SO2(g)、CO2(g)、S(g)各0.2mol,此时v(正)_________v(逆)。(填>、<或=)
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0。在催化剂作用下,NO转化率与温度的关系如图所示:
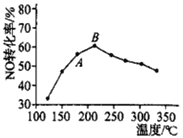
①图中A点处NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。
②B点之后,NO转化率降低的原因可能是_________(选填字母)。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应的活化能增大
(4)2SO2(g)+O2(g) 2SO3(g) △H=-198 kJ/mol是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较小的是_________(填“a”或“b”)。
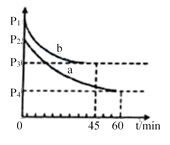
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/ c(CO32-) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com