
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
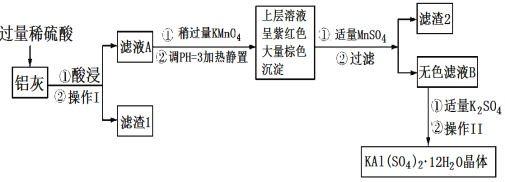
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断正确的是( )

A.反应①、②属于氧化还原反应,③属于非氧化还原反应
B.Y的离子半径比Z的离子半径小
C.反应③可以证明X的非金属性强于W
D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:
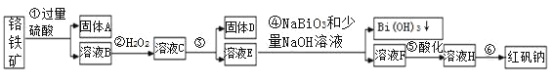
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
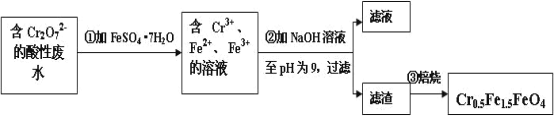
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol·L-1的醋酸溶液中不断滴加0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中微粒浓度大小关系的描述不正确的是( )

A.a点时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点时:c(Na+)>c(CH3COO-)
C.c点时:c(OH-)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、CO32-、SO42-、NO3-中的若干种离子,离子浓度均为0.1mol/L,某同学进行如下实验。下列说法正确的是

A. 无法确定沉淀C 的成分
B. 无法确定原试液中是否存在K+、Al3+、Cl-、
C. 试液中可能含有CO32-、K+、NH4+
D. 试液中一定存在的离子为NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g) (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是

A.x=3
B.该温度下,K=0.125 L2/mol2
C.从反应开始到平衡,该反应速率为v(H2O)=3mol·L-1·min-1
D.t1时刻,保持温度和容积不变,再充入1mol H2O(g),重新达到平衡时,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收。二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
CO2+![]()
![]()
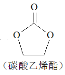 +H2O
+H2O
(1)锌基态原子核外电子排布式为_________;写出一种与CO2互为等电子体的分子的化学式:__________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,提供空轨道的是_____(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为______;1mol碳酸乙烯酯中含有的![]() 键数目为______。
键数目为______。
(4)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________;
②甲醛分子的空间构型是______________(用文字描述);
(5)抗坏血酸的分子结构如图 1 所示,推测抗坏血酸在水中的溶解性:______(填“难溶于水”或“易溶于水”) ;一个Cu2O 晶胞(见图 2)中,Cu 原子的数目为______ 。
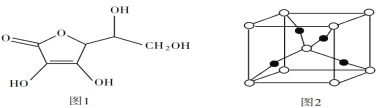
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com