
【题目】一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g) (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是

A.x=3
B.该温度下,K=0.125 L2/mol2
C.从反应开始到平衡,该反应速率为v(H2O)=3mol·L-1·min-1
D.t1时刻,保持温度和容积不变,再充入1mol H2O(g),重新达到平衡时,![]() 将减小
将减小
【答案】CD
【解析】
A.同一可逆反应、同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,参加反应的n(H2O)=(52)mol=3mol,n[(H2O)x]=(10)mol=1mol,所以n(H2O):n[(H2O)x]=3mol:1mol=3:1,所以x=3,故A正确;
B.根据A项分析,x=3,结合图象可知,该温度下化学平衡常数K=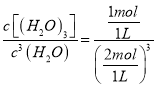 =0.125 L2/mol2,故B正确;
=0.125 L2/mol2,故B正确;
C.反应速率为v= ![]() ,题中未给出达到平衡所用的时间,无法计算平衡常数,故C错误;
,题中未给出达到平衡所用的时间,无法计算平衡常数,故C错误;
D.t1时刻,保持温度不变,再充入1mol H2O(g),压强增大,平衡向气体体积减小的方向移动,所以![]() 将增大,故D错误;
将增大,故D错误;
答案选CD。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
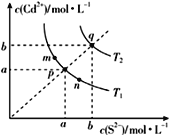
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向n点的溶液中加入少量CdCl2固体,溶液组成由n沿npm线向m方向移动
D.温度升高时,p点的饱和溶液的组成由p沿pq线向q方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
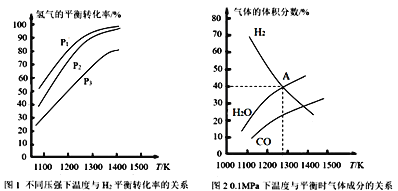
(1)该反应的平衡常数表达式为K=___。
(2)由图1可知,该反应ΔH__0(填“>”或“<”),p1、p2、p3由大到小的顺序为___。
(3)由图2可知,A点时H2的平衡转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746kJ/mol
反应Ⅱ:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H=-1200kJ/mol
则反应NO2(g) + CO(g) CO2(g) + NO(g)的△H=_____________kJ/mol。
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1mol CO和0.5mol SO2发生反应:2CO(g)+ SO2(g) 2CO2(g)+S(g)。实验测得生成的CO2的体积分数(ψ)随着时间的变化曲线如图所示:
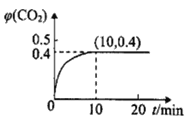
①达到平衡时,SO2的转化率为_____________。
②该温度下反应的平衡常数K=______________。
③其它条件保持不变,再向上述平衡体系中充入CO(g)、SO2(g)、CO2(g)、S(g)各0.2mol,此时v(正)_________v(逆)。(填>、<或=)
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0。在催化剂作用下,NO转化率与温度的关系如图所示:
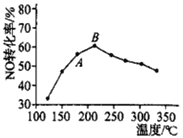
①图中A点处NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。
②B点之后,NO转化率降低的原因可能是_________(选填字母)。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应的活化能增大
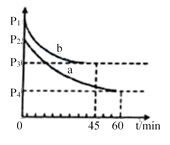
(4)2SO2(g)+O2(g) 2SO3(g) △H=-198 kJ/mol是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较小的是_________(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2 Na2CO3·3 H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10 H2 O)、H2O2等为原料制备过碳酸钠的工艺流程如下:

已知2CrO42-+2H+=Cr2O72-+H2O , pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。
回答下列问题:
(1)Na2CrO4中Cr元素的化合价为___
(2)Ksp(CaCrO4)___(填“>”或“<”)Ksp(CaSO4)。
(3)流程中循环物质X为___(填化学式)。
(4)步骤II中发生反应的化学方程式为_________
(5)步骤I一III是为了制得纯碱,从环境保护的角度看,可能的不足之处是___
(6)步骤V合成时,加入95%的乙醇的目的是___
(7)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①滴定到终点时,溶液呈___(填“无色”或“浅红色”)。
②过氧化物的活性氧是指过氧化物单独用催化剂催化分解时放出氧气的质量与样品的质量之比。该实验测得的产品中活性氧为___(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
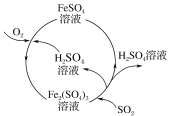
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com