
【题目】为了使(NH4)2SO4溶液中![]() 接近2:1,可采取的措施是( )
接近2:1,可采取的措施是( )
A.加热B.加适量NaOH(s)
C.加水D.通HCl
【答案】D
【解析】
A.(NH4)2SO4溶液中铵根离子水解,水解反应吸热,加热促进铵根离子的水解,c(NH4+)减小,c(SO42)不变,c(NH4+)和c(SO42)之比小于2:1,故A错误;
B.(NH4)2SO4溶液中铵根离子水解生成一水合氨和氢离子,加入氢氧化钠会促进铵根的水解,减少铵根离子,c(NH4+)和c(SO42)之比小于2:1,故B错误;
C.溶液越稀越水解,所以加水促进铵根离子的水解,导致c(NH4+)和c(SO42)之比小于2:1,故C错误;
D.(NH4)2SO4溶液中铵根离子水解生成一水合氨和氢离子,通HCl,抑制铵根离子的水解,c(NH4+)增大,使c(NH4+)和c(SO42)之比更接近2:1,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)绿矾是一种重要的硫酸盐,其化学式为FeSO4·7H2O,某化学兴趣小组通过实验探究来测定某绿矾样品中FeSO4·7H2O的含量,步骤如下:
i.称取上述样品9.0g,配成250 mL准确浓度的FeSO4溶液;
ii.最取25.00 mL上述溶液于锥形瓶中,用0.02000 mol·L-1的酸性KMnO4溶液与之完全反应,消耗KMnO4溶液30.00 mL(杂质不与KMnO4溶液反应)。
①配制FeSO4溶液时,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___;配制溶液过程中未洗涤烧杯、玻璃棒,会造成所配溶液浓度____(填“偏大”、“偏小”或“无影响”)。
②步骤ii中反应的离子方程式为5Fe2++MnO4-+X=5Fe3++Mn2++4H2O,则X的化学式为______,其系数为______。
③该样品中FeSO4·7H2O的质量百分含量为____(计算结果保留1位小数)。
(2)工业上用氯化铁腐蚀铜箔制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁溶液,准备采用下列步骤:

回答下列问题:
①请写出试剂a的化学式____,试剂b的名称____。
②滤液X、Z中均含有同一种溶质,它们转化为氯化铁溶液的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)2C(g)+2D(g),其中反应速率最快的是( )
A.v(D)=0.30mol·L-1·s-1B.v(A)=0.50mol·L-1·s-1
C.v(B)=0.60mol·L-1·s-1D.v(C)=0.50mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断正确的是( )

A.反应①、②属于氧化还原反应,③属于非氧化还原反应
B.Y的离子半径比Z的离子半径小
C.反应③可以证明X的非金属性强于W
D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有![]() 某气体(由双原子分子构成),其摩尔质量为
某气体(由双原子分子构成),其摩尔质量为![]() ,阿伏加德罗常数用
,阿伏加德罗常数用![]() 表示,试求
表示,试求
①该气体在标准状况下的体积为____![]() 。
。
②该气体所含原子数为____。
(2)用双线桥表示铜与浓硫酸反应的电子转移方向和数目:__________________

当有![]() 被还原时,转移电子的物质的量为____
被还原时,转移电子的物质的量为____![]() ,生成标准状况下
,生成标准状况下![]() 的体积为___
的体积为___![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:
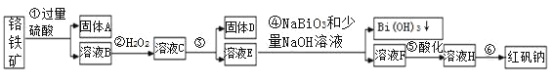
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
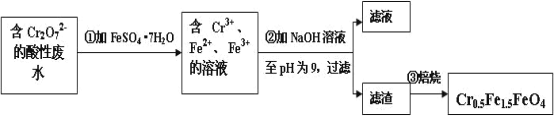
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol·L-1的醋酸溶液中不断滴加0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中微粒浓度大小关系的描述不正确的是( )

A.a点时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点时:c(Na+)>c(CH3COO-)
C.c点时:c(OH-)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g) (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是

A.x=3
B.该温度下,K=0.125 L2/mol2
C.从反应开始到平衡,该反应速率为v(H2O)=3mol·L-1·min-1
D.t1时刻,保持温度和容积不变,再充入1mol H2O(g),重新达到平衡时,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com