
 ;
; ;σ键;
;σ键;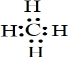 ;
;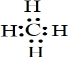 ;O=C=O;SiO2+2OH-═SiO32-+H2O;
;O=C=O;SiO2+2OH-═SiO32-+H2O;

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
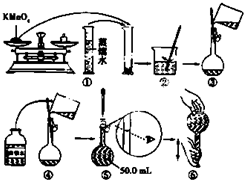
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
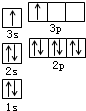 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
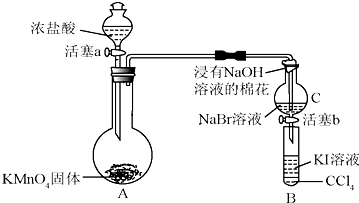
查看答案和解析>>
科目:高中化学 来源: 题型:
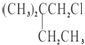 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.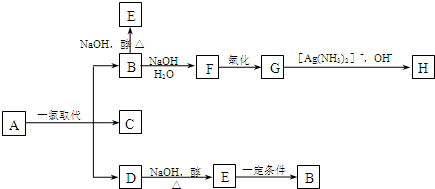
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①④ | C、①③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
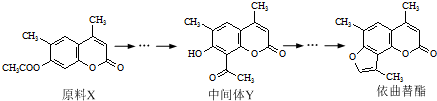
| A、原料X酸性条件下水解产物与中间体Y互为同分异构体 |
| B、原料X不能使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、氧化等反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com