
【题目】铬铁矿的成分主要为FeCr2O4,另含有少量Al2O3和SiO2。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
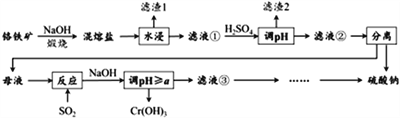
已知“混熔盐”中含有Na2CrO4和NaFeO2等成分,其中NaFeO2极易水解。试回答下列问题:
(1)“滤渣1”为红褐色沉淀,其化学式为_________________;通过水浸生成红褐色沉淀的化学方程式为_________________________________。
(2)向滤液①中加H2SO4“调“pH”的目的:一是使CrO42-转化为Cr2O72-,离子方程式为___________________________________;二是____________________________。
(3)“煅烧”铬铁矿时,主要成分反应的化学方程式为____________________________。
(4)根据下图溶解度(S)~温度(T)曲线判断,对滤液②进行的最佳“分离”方法为_____________(填序号)。
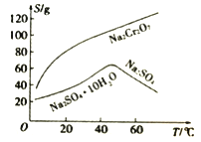
A.蒸发结晶 B.蒸发浓缩,趁热过滤 C.蒸发浓缩,冷却结晶,过滤
(5)“反应”的离子方程式为____________________________。
(6)Cr(OH)3溶于盐酸生成配离子[CrCln(H2O)6-n]x+。0.0015mol[CrCln(H2O)6-n]x+与氢离子交换树脂(HR)完全发生离子交换:[CrCln(H2O)6-n]x++xHR→Rx[CrCln(H2O)6-n] +xH+,生成的H+可与25.00mL 0.1200mol/L NaOH溶液恰好中和。则该配离子的化学式为__________________。
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少___________?(列式计算)
【答案】 Fe(OH)3 NaFeO2+2H2O = NaOH+Fe(OH)3 2 CrO42-+2H+= Cr2O72-+H2O 使AlO2-、SiO32-转化为沉淀,便于过滤分离 4FeCr2O4+20NaOH+7O2![]() 8Na2CrO4+4NaFeO2+10H2O B 3SO2+Cr2O
8Na2CrO4+4NaFeO2+10H2O B 3SO2+Cr2O![]() +2H+===2Cr3++3SO42-+H2O [CrCl(H2O)5]2+ Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1
+2H+===2Cr3++3SO42-+H2O [CrCl(H2O)5]2+ Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1
c(OH-)=1.0×10-9 mol·L-1
c(H+)=![]() =1.0×10-5 mol·L-1
=1.0×10-5 mol·L-1
pH=-lg 10-5=5
【解析】考查化学工艺流程,(1)“滤渣1”为红褐色沉淀,其化学式为Fe(OH)3,混熔盐中含有Na2CrO4和NaFeO2,其中NaFeO2极易水解,因此水浸生成红褐色沉淀的化学方程式为NaFeO2+2H2O=Fe(OH)3+NaOH;(2)CrO42-水中存在:2CrO42-+2H+![]() Cr2O72-+H2O,加入硫酸,促进平衡向正反应方向进行,即离子方程式为2CrO42-+2H+=Cr2O72-+H2O,矿石中含有Al2O3和SiO2,与NaOH高温下,生成NaAlO2和Na2SiO3,加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3,因此目的二使AlO2-、SiO32-转化为沉淀,便于过滤分离;(3)根据产生得到Na2CrO4和NaFeO2,因此方程式为 4FeCr2O4+20NaOH+7O2
Cr2O72-+H2O,加入硫酸,促进平衡向正反应方向进行,即离子方程式为2CrO42-+2H+=Cr2O72-+H2O,矿石中含有Al2O3和SiO2,与NaOH高温下,生成NaAlO2和Na2SiO3,加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3,因此目的二使AlO2-、SiO32-转化为沉淀,便于过滤分离;(3)根据产生得到Na2CrO4和NaFeO2,因此方程式为 4FeCr2O4+20NaOH+7O2 ![]() 8Na2CrO4+4NaFeO2+10H2O;(4)分离得到Na2SO4,根据图像,操作方法是蒸发浓缩、趁热过滤,故选项B正确;(5)调节pH,得到Cu(OH)3,因此通入SO2的目的是还原Cr2O72-,因此离子方程式为3SO2+Cr2O +2H+=2Cr3++3SO42-+H2O ;(6)根据离子方程式,x=
8Na2CrO4+4NaFeO2+10H2O;(4)分离得到Na2SO4,根据图像,操作方法是蒸发浓缩、趁热过滤,故选项B正确;(5)调节pH,得到Cu(OH)3,因此通入SO2的目的是还原Cr2O72-,因此离子方程式为3SO2+Cr2O +2H+=2Cr3++3SO42-+H2O ;(6)根据离子方程式,x=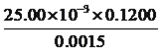 =2,该配离子中Cr显+3价,即n=1,配离子是[CrCl(H2O)5]2+;(7)Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1,根据溶度积求出c(OH-)=1.0×10-9 mol·L-1 ,c(H+)=
=2,该配离子中Cr显+3价,即n=1,配离子是[CrCl(H2O)5]2+;(7)Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1,根据溶度积求出c(OH-)=1.0×10-9 mol·L-1 ,c(H+)=![]() =1.0×10-5 mol·L-1 ,pH=-lg 10-5=5。
=1.0×10-5 mol·L-1 ,pH=-lg 10-5=5。


科目:高中化学 来源: 题型:
【题目】如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H22NH3;②N2+O22NO
根据图中的数据判断下列说法正确的是( )
A.只有反应①是放热反应
B.升温,反应①的速率减小反应②的速率增大
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题:
(1)F的元素符号为_________,E、F的简单离子中半径较大的是______(填离子符号)。
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要产品,该化合物电子式为__________。
(3)B、C简单氢化物中稳定性较强的是__________(填分子式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子稳定结构,则该化合物的化学式为___________;B的简单氢化物与F的单质常温下可发生置换反应,请写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,电流计指针会偏转,正极变粗,负极变细,符合这种情况的是

A. 正极:Cu 负极:Zn S:稀H2SO4
B. 正极:Zn 负极:Cu S:CuSO4溶液
C. 正极:Ag 负极:Zn S:AgNO3溶液
D. 正极:Fe 负极:Cu S:AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A. ①②中Mg作负极、③④中Fe作负极
B. ②中A1作负极,电极反应式为2A1-6e-=2Al3+
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)在现代化学中,常利用______________(填“原子光谱”或“分子光谱”) 上的特征谱线来鉴定元素,称为光谱分析。
(2)基态P原子的价电子排布式为_______,同周期中第一电离能比P小的元素有_______种。
(3)在水中的溶解度BBr3_________PBr3(填“>”或“<”),原因是____________________。
(4)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,阴阳离子均带一个电位电荷,经测定其中P-Br键键长均相等。写出该导电熔体中阳离子的电子式:_____________,其中P原子的杂化轨道类型是_____________________。
(5)已知磷化硼晶体中P原子作面心立方最密堆积,若某个P的原子坐标为(0,0,0),则晶胞中其余P原子的坐标为______________ (写出一个即可),B原子填入四面体空隙中,B的原子坐标分别为(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10m/L的弱碱BOH滴定10.00 ml a mol/L的盐酸,溶液的pH与所加BOH溶液体积(V)的关系如图所示。已知N点溶液中存在关系式:c(C1—)=c(B+)+c(BOH)。下列说法正确的是
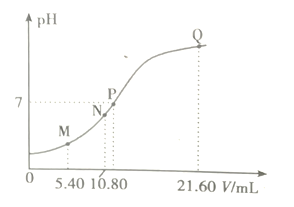
A. M点溶液中存在c(H+)=c(OH—)+2c(BOH)+c(B+)
B. N、Q两点溶液中BOH电离平衡常数:N<Q
C. P点BOH过量,此时溶液中c(B+)>c(Cl—)
D. a<0.108
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com