
����Ŀ����2L�ܱ���������800��ʱ��Ӧ2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)������Ӧ�ڵ�5sʱNO��ת������___________����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������V(O2)=__________��
(2)��ͼ�б�ʾNO2�ı仯��������__________��

(3)��ʹ�÷�Ӧ�ķ�Ӧ�����������__________��
A.��ʱ�����NO2���� B.�ʵ������¶� C.����O2��Ũ�� D.ѡ���Ч����
(4)��˵���÷�Ӧ�Ѵﵽƽ��״̬����___________��
A.v(NO2)=2v(O2) B.������ѹǿ���ֲ���
C.v��(NO)=2v��(O2) D.�������������ֲ���
���𰸡� 70% 0.0015mol/(Ls) b BCD BC
����������1��һ��������ת�������ѷ�Ӧ��һ����������ʼʱһ�����������ʵ����ı�ֵ���ȼ���һ�������ķ�Ӧ���ʣ��ٸ���ͬһ��ѧ��Ӧ��ͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȼ��������ķ�Ӧ���ʣ�
��2�����ݱ���֪�����ŷ�Ӧ�Ľ��У�һ�����������ʵ�����С����ƽ��������Ӧ�����ƶ����������������ʵ�����������һ�������Ͷ�������֮��ת����ϵʽ����ƽ��ʱ�������������ʵ������Ӷ�ȷ�����ߣ�
��3��������������Է�Ӧ���ʵ�Ӱ��������
��4������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䡣
��1��������Ӧ�ڵ�5sʱ����NO��0.020mol��0.006mol��0.014mol����NO��ת������0.014mol/0.020mol��100%��70%�����ݱ������ݿ�֪0��2sʱ��v��NO��=(0.0200.008)mol/(2L��2s)=0.003mol/��L��s����ͬһ��ѧ��Ӧ��ͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȣ�����v��O2��=1/2v��NO��=0.0015mol/(Ls)��
��2�����ݱ���֪�����ŷ�Ӧ�Ľ��У�һ�����������ʵ�����С����ƽ��������Ӧ�����ƶ����������������ʵ�����������Ӧ�ﵽƽ��״̬ʱ���μӷ�Ӧ��n��NO��=��0.020-0.006��mol=0.014mol�����ݶ���������һ�������Ĺ�ϵʽ֪��ƽ��״̬ʱ����n��NO2�����ڲμӷ�Ӧ��n��NO��������Ϊ0.014mol��c��NO2��=0.014mol��2L=0.007mol/L�����Ա�ʾNO2�ı仯��������b��
��3��A����ʱ�����NO2���壬��Ӧ���ʽ��ͣ�A����B���ʵ������¶ȣ���Ӧ��������B��ȷ��C������O2��Ũ�ȣ���Ӧ��������C��ȷ��D��ѡ���Ч�Ĵ���������Ӧ���ʣ�D��ȷ����ѡBCD��
��4��A.v(NO2)=2v(O2)ʱ���÷�Ӧ��һ���ﵽƽ��״̬��A����B���÷�Ӧ��һ��������������ı�Ŀ��淴Ӧ�����ﵽƽ��״̬ʱ�������ʵ�Ũ�Ȳ��䣬��������ѹǿ���ֲ��䣬B��ȷ��C��v�棨NO����v����O2��=2��1ʱ���÷�Ӧ�ﵽƽ��״̬��C��ȷ��D�����������غ㶨��֪�����������ʼ�ղ��䣬���Բ��ܾݴ��ж��Ƿ�ﵽƽ��״̬��D����ѡBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����

A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪCu2+ + 2e = Cu
C. a��b�õ������Ӻ���Һ�е�Cu2+��ͭ�缫�ƶ�
D. a��b�õ������Ӻ�FeƬ�Ϸ�����ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����SO2�����Ƿ�ﵽ�ŷű��ķ�Ӧԭ����SO2 +H2O2 + BaCl2 ===BaSO4��+ 2HCl��NA��ʾ����٤������������˵����ȷ���ǣ� ��
A. 0.1 mol BaCl2����������������Ϊ0.1NA
B. 25 ��ʱ��pH =1��HCl��Һ�к���H+����ĿΪ0.1NA
C. 17 g H2O2�к��зǼ��Լ���ĿΪ0.5NA
D. ����2.33 g BaSO4����ʱ��ת�Ƶ�����ĿΪ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijɷ���ҪΪFeCr2O4������������Al2O3��SiO2���Ӹ���������ȡ�������Ļ��������ø�����Ĺ����������£�
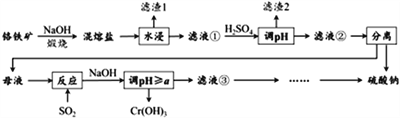
��֪�������Ρ��к���Na2CrO4��NaFeO2�ȳɷ֣�����NaFeO2����ˮ�⡣�Իش��������⣺
(1)������1��Ϊ���ɫ�������仯ѧʽΪ_________________��ͨ��ˮ�����ɺ��ɫ�����Ļ�ѧ����ʽΪ_________________________________��
(2)����Һ���м�H2SO4������pH����Ŀ�ģ�һ��ʹCrO42-ת��ΪCr2O72-�����ӷ���ʽΪ___________________________________������____________________________��
(3)�����ա�������ʱ����Ҫ�ɷַ�Ӧ�Ļ�ѧ����ʽΪ____________________________��
(4)������ͼ�ܽ��(S)���¶�(T)�����жϣ�����Һ�ڽ��е���ѡ����롱����Ϊ_____________(�����)��
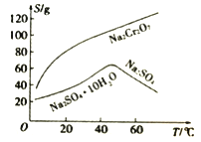
A.�����ᾧ B.����Ũ�������ȹ��� C.����Ũ������ȴ�ᾧ������
(5)����Ӧ�������ӷ���ʽΪ____________________________��
(6)Cr(OH)3������������������[CrCln(H2O)6-n]x+��0.0015mol[CrCln(H2O)6-n]x+�������ӽ�����֬(HR)��ȫ�������ӽ�����[CrCln(H2O)6-n]x++xHR��Rx[CrCln(H2O)6-n] +xH+�����ɵ�H+����25.00mL 0.1200mol/L NaOH��Һǡ���к͡���������ӵĻ�ѧʽΪ__________________��
(7)��֪25��ʱ��Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]=1.0��10-32����ʹCr3+ǡ����ȫ����������Һ��c(Cr3+)=1.0��10-5mol/Lʱ��Ӧ����pH����СֵaΪ����___________?(��ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.Ħ���ǹ��ʵ�λ�Ƶ��߸�����������֮һ
B.���ʵ����DZ�ʾ�����ĵ�λ
C.Ħ�������ʵ����ĵ�λ������Ϊmol
D.1mol�κ����ʶ�����Լ6.02��1023��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ������ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱN�缫���������٣���ش��������⣺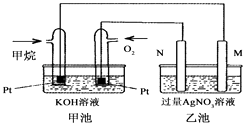
��1��M�缫�IJ����� �� ��缫��ӦʽΪ��N�ĵ缫������ �� �缫��ӦʽΪ��
��2��ͨ�����IJ��缫�ĵ缫��ӦʽΪ ��
��3���ڴ˹����У��ҳ���ijһ�缫����������4.32gʱ���׳�����������������Ϊ L����״���£���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������֤�����������̼������Ӧ����ȷ��������װ����ͼ��ʾ(��֪��PdC12��Һ��CO�ܲ�����ɫ��Pd)������˵���������

A. װ�âٵ�������������ȡH2��NH3������
B. װ�â���ʯ��ˮ����Ǻ��ٵ�ȼ�ƾ���
C. װ�âڢ��зֱ�ʢװ����Na2CO3��Һ��ŨH2SO4
D. װ�â����к�ɫ�����������ķ�Ӧ��PdC12+CO+H2O=Pd��+CO2+2HC1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ�����ʾNH3+HCl=NH4Cl�е�����������в���ȷ����
A. ������Ϊ8�ĵ�ԭ�ӣ�![]() B. �Ȼ�淋ĵ���ʽ��
B. �Ȼ�淋ĵ���ʽ��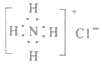
C. HCl�Ľṹʽ:H-Cl D. ��ԭ�ӵĽṹʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ����뺬���Ļ�����ɲ��������������ơ����г���һ�ֳ����IJ���ҩƷ����˵���鲿������ժ¼���£� �����ÿƬ������������0.1g
����Ӧ֢������ȱ����ƶѪ֢��Ԥ���������ã�
�����ء��ܹ⡢�ܷ⡢�ڸ��ﴦ���森
��ҩ������á���ά����Cͬ���������ӱ�Ʒ���գ���ҩƬ��ˮ���Ҵ����ܽ�Ȳ���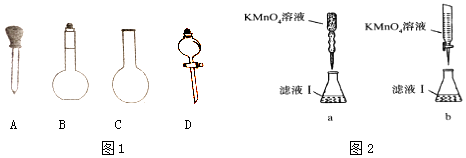
��ҩƷ��Fe2+�Ỻ�����������ҹ涨��ҩ����Fe2+�������ʣ��Ѿ�������Fe2+��������Fe2+�������ı�ֵ������10.00% �������ٷ��ã�
��1��ʵ���ҿɲ���H2SO4�ữ��KMnO4��Һ���ԡ������ơ��е�Fe2+���еζ�������ҩƷ�������ɷݲ���KMnO4��Ӧ�����ζ����̷������·�Ӧ���벹�������� Fe2++MnO4��+=Mn2+++ ��
��2��ʵ��ǰ����������Ԫ����������Ϊ20.00%�ġ������ơ�20.0g������ȫ������ϡH2SO4�У����Ƴ�250ml��Һ������ʱͼ1���������϶�����Ҫ���� �� �������ƣ�
��3��ȡ���ƺõ���Һ20.00ml����ƿ�У���0.1000mol/L��1��KMnO4��Һ�ζ���ijͬѧ�����ͼ2�ζ���ʽ���гֲ�����ȥ�������������������ĸ��ţ������ζ������У���ƿ�д���Һ�ɽ�������������Fe2+������������ƫ�ߡ�ƫ�ͻ䣩��
��4�����β����������£�
��� | V�� | Vĩ | V�� |
�� | 0.10mL | 9.71mL | 9.61mL |
�� | 1.50mL | 11.09mL | 9.59mL |
�� | 0.50mL | 11.10mL | 11.60mL |
����á������ơ�����ҩƷFe2+��������Ϊ%��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com