
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
科目:高中化学 来源: 题型:
【题目】已知 25℃时部分弱电解质的电离平衡常数数据如表:
化学式 | HSCN | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.3×10﹣1 | 1.8×10﹣5 | Ka1=4.3×10﹣1Ka2=5.6×10﹣1 | 3.0×10﹣8 |
回答下列问题:
(1)写出碳酸的主要的电离方程式 . 若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
(3)25℃时,将 20mL0.1molL﹣1CH COOH 溶液和 20mL0.1molL﹣1HSCN 溶液分别与 20mL0.1molL﹣1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.
反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)﹣c(CH3COO﹣)=mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2 , 发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A. ①②中Mg作负极、③④中Fe作负极
B. ②中A1作负极,电极反应式为2A1-6e-=2Al3+
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O ![]() Cu2O+H2↑.下列说法正确的是( )
Cu2O+H2↑.下列说法正确的是( ) 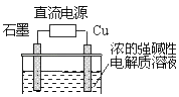
A.石墨电极上产生氧气
B.铜电极发生还原反应
C.铜电极接直流电源的正极
D.当有0.1mol电子转移时,有0.1molCu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( ) 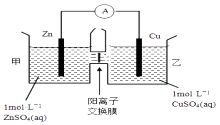
A.铜电极上发生还原反应
B.电池工作一段时间后,甲池的c(SO42﹣)不变
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气和金属铁反应制备无水三氧化铁,该化合物呈棕红色、易潮解,100℃左右时升华。装置如下:
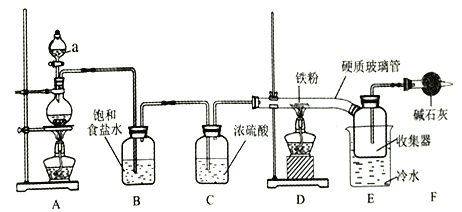
(1)仪器a的名称是________。
(2)A中反应的化学方程式是________。
(3)碱石灰的作用是________。
(4)反应开始时,先点燃_______处的酒精灯(填“A”或“D”)。
(5)D中反应开始后,收集器中有大量棕红色烟生成,反应结束后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加水溶解,充分反应后,加入KSCN溶液未变红色,其原因是__________。(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com