
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( ) 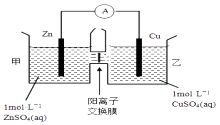
A.铜电极上发生还原反应
B.电池工作一段时间后,甲池的c(SO42﹣)不变
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】D
【解析】解:A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A正确;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42﹣)不变,故B正确;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e﹣=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,阴离子不能通过阳离子交换膜,故D错误,
故选:D.
由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示NH3+HCl=NH4Cl中的相关微粒,其中不正确的是
A. 中子数为8的氮原子:![]() B. 氯化铵的电子式:
B. 氯化铵的电子式: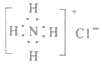
C. HCl的结构式:H-Cl D. 氯原子的结构示意图: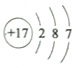
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.左、下方区域的金属元素
B.金属元素和非金属分界线附近的元素
C.右、上方区域的非金属元素
D.稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 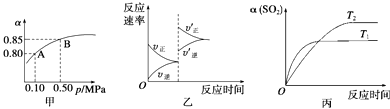
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下: 【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大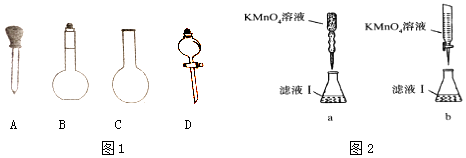
该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整: Fe2++MnO4﹣+=Mn2+++ .
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是 . (填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L﹣1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填偏高、偏低或不变).
(4)三次操作读数如下:
序号 | V初 | V末 | V标 |
① | 0.10mL | 9.71mL | 9.61mL |
② | 1.50mL | 11.09mL | 9.59mL |
③ | 0.50mL | 11.10mL | 11.60mL |
计算该“速力菲”补铁药品Fe2+的氧化率为%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3含有相同的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com