
【题目】下列说法正确的是( )
A.摩尔是国际单位制的七个基本物理量之一
B.物质的量是表示数量的单位
C.摩尔是物质的量的单位,符号为mol
D.1mol任何物质都含有约6.02×1023个原子
科目:高中化学 来源: 题型:
【题目】抗过敏药物H 可通过如下合成路线制备。

已知: ![]()
(1)A物质的名称为_______________,B中含氧官能团的名称为__________________。
(2)由B生成C的反应类型为________________,由E 生成F 的反应类型为_______________。
(3)下列试剂可用于鉴别![]() 和
和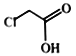 的有________(填标号)。
的有________(填标号)。
a.NaOH 溶液 b.小苏打溶液 c.AgNO3溶液 d.溴的CCl4溶液
(4)由D生成E的化学方程式为____________________________________。
(5)己知联苯由两个苯环通过单键连接而成(![]() ),分子中苯环间的单键可以自由旋转。则B的同分异构体中含联苯基团且能发生银镜反应的至少有____种。
),分子中苯环间的单键可以自由旋转。则B的同分异构体中含联苯基团且能发生银镜反应的至少有____种。
(6)M(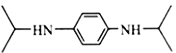 )是制备合成染料、颜料的重要中间产物。参照上面合成路线,请以丙酮(
)是制备合成染料、颜料的重要中间产物。参照上面合成路线,请以丙酮(![]() )和对苯二胺(
)和对苯二胺(![]() )为主要有机原料设计M的合成路线________________(其它试剂任选)。
)为主要有机原料设计M的合成路线________________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A. ①②中Mg作负极、③④中Fe作负极
B. ②中A1作负极,电极反应式为2A1-6e-=2Al3+
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 用电子式表示HCl的形成过程: ![]()
B. ![]() 中的原子核内的中子数与核外电子数之差是99
中的原子核内的中子数与核外电子数之差是99
C. 在空气中加热金属锂:4Li+O2![]() 2Li2O
2Li2O
D. (CH3)2CHC2H5和CH3CH2CH(CH3)2属于同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O ![]() Cu2O+H2↑.下列说法正确的是( )
Cu2O+H2↑.下列说法正确的是( ) 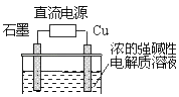
A.石墨电极上产生氧气
B.铜电极发生还原反应
C.铜电极接直流电源的正极
D.当有0.1mol电子转移时,有0.1molCu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com