
【题目】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式__________。
(2)Cm-、E(m-1)-的还原性强弱顺序为__________(用离子符号表示),能证明其还原性强弱的离子方程式为____________________。
(3)写出B单质与A元素的最高价氧化物对应水化物的溶液反应的离子方程式___________________。
(4)用于判断C和D非金属性强弱的依据是__________
A.气态氢化物的稳定性 B.置换反应 C.与氢气化合难易程度
D.最高价含氧酸的酸性 E.得电子数目多少
F.两单质在自然界的存在形式
【答案】 ![]() S2->Cl- Cl2 + S2-= 2Cl-+ S↓ 2Al+2OH-+2H2O =2AlO2-+3H2 ↑ ABC
S2->Cl- Cl2 + S2-= 2Cl-+ S↓ 2Al+2OH-+2H2O =2AlO2-+3H2 ↑ ABC
【解析】A、B、C、D、E是位于短周期的主族元素,①热稳定性:HmD>HmC,则非金属性D>C且二者位于同主族,所以D位于第二周期、C位于第三周期;②Cm-、E(m-1)-具有相同的电子层结构,则E的原子序数比C的大1,二者位于同周期,都属于第三周期;③A与B在同周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,则A位于第IA族、B位于第IIIA主族;④A与B质子数之和是D质子数的3倍,因为D为第二周期主族元素,所以A和B的质子数之和介于9~27之间,A位于第IA族、B位于第IIIA主族,若A是Li元素、B是B(硼)元素,二者质子数之和不是3的倍数,所以A是Na元素、B是Al元素,D是O元素,又因为D和C同主族,则C是S元素,由E的原子序数比C的大1进一步推出:E是Cl元素,m=2。
(1)HmDm是H2O2,电子式为:![]() 。
。
(2)Cm-、E(m-1)-分别为:S2-、Cl-,故还原性S2->Cl-,能证明其还原性强弱的离子方程式为:Cl2+S2-=2Cl-+S↓。
(3)A是Na元素,B是Al元素,铝与氢氧化钠溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
(4)C为S元素,D为O元素,位于同主族,与氢气化合越容易、气态氢化物越稳定非金属性越强,故A、C正确;B项,非金属性越强单质氧化性越强,可以通过非金属间的置换反应判断,故B正确;D项,因为O元素没有最高价含氧酸,所以D错误;E项,不能看得电子多少,而看得电子难易,故E错误。综上,选ABC。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】同一主族从上到下,有关卤族元素的说法正确的是( )
A.原子半径逐渐增大
B.单质氧化性逐渐增强
C.气态氢化物的稳定性逐渐增强
D.都有最高价氧化物的水化物,化学式为HXO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
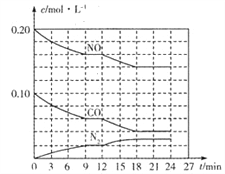
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述,正确的是
A. 构成原电池的正极和负极必须是两种活泼性不同的金属
B. 原电池是将化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2mol C和1mol He,此时K 停在0处,发生反应2A(g)+B(g)![]() 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )

A.达平衡后,K最终停留在左侧刻度0~2之间
B.若平衡时K在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为 K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分) ( )
A.提高CO2充气压力,饮料中c(A-)不变
B.当pH为5.0时,饮料中![]()
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A-> HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种物质,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥邻二甲苯 ⑦乙醛 ⑧环己烯
A. ③④⑤⑧ B. ④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图。下列有关氢氧燃料电池的说法不正确的是

A.由于A、B两电极没有活动性差别,不能构成原电池
B.A电极是负极,电极上发生氧化反应
C.产物为无污染的水,属于环境友好的绿色电池
D.外电路中电流由B电极通过导线流向A电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com