
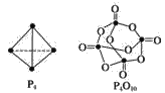
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—PakJ·mol-1、P—ObkJ·mol-1、P=OckJ·mol-1、O=OdkJ·mol-1。根据图示的分子结构和有关数据计算该反应的反应热______。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知常温下水的离子积常数Kw=1.0×10-14,在100℃时水的离子积常数Kw=1.0×10-12。将常温下的下列溶液加热至100℃(忽略溶液体积变化),溶液的pH不变的是( )
A.Na2SO4溶液B.稀H2SO4溶液C.NaOH溶液D.HCl的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
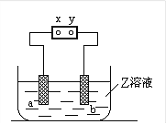
【题目】右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
a电极 | b电极 | x电极 | Z溶液 | |
A | 铜 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CaSO4(s)![]() Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)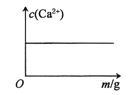
B.加少量蒸馏水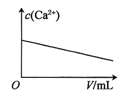
C.加少量硫酸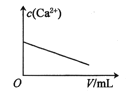
D.适当升高温度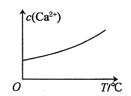
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
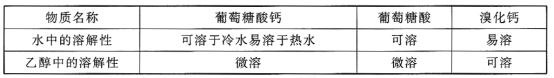
实验流程如下:
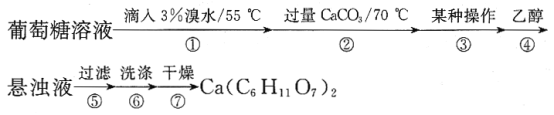
回答下列问题:
(1)第①步中溴水氧化葡萄糖时,甲同学设计了如图所示装置。

①你认为缺少的仪器是__。
②甲同学在尾气吸收装置中使用倒立漏斗的目的是__。
(2)第②步CaCO3固体过量,其目的是__。
(3)本实验中___(填“能”或“不能”)用CaCl2替代CaCO3,理由是__。
(4)第③步“某种操作”名称是__。
(5)第④步加入乙醇的作用是__。
(6)第⑥步中洗涤操作主要是除去沉淀表面可能含有的溴化钙,洗涤剂最合适的是__(填标号)。
A.冷水 B.热水 C.乙醇 D.乙醇—水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
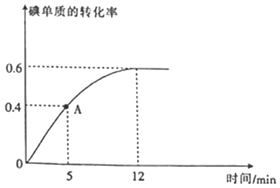
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气是一种清洁能源,氧气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ![]()
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ![]()
2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ![]()
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)请写出F离子的电子排布式_________。
(2)写出X的化学式________,X的化学名称为______。
(3)写出X涉及化工生产中的一个化学方程式:__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:____________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为__________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。
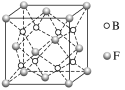
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com