
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
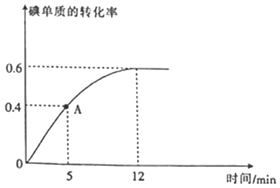
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
【答案】![]()
![]()
![]()
![]() 9
9 ![]() AD
AD ![]()
【解析】
(1)![]() ,
,![]() ,
,![]()
![]() ,根据盖斯定律
,根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ;
;
(2)由图可知,A点时反应正向进行,碘单质的转化率为![]() ,则
,则![]() ,根据
,根据![]() 计算
计算![]() ,结合反应的速率之比等于计量数之比求出
,结合反应的速率之比等于计量数之比求出![]() ;
;
(3)根据反应三段式计算达到平衡状态时氢气的物质的量,将平衡分压代入![]() 表达式
表达式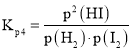 中计算
中计算![]() ;由于反应
;由于反应![]() ,即
,即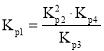 ,则
,则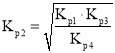 ;
;
(4)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性,此时溶质为
的氨水等体积混合后,溶液呈中性,此时溶质为![]() ,因为溶液呈中性,则
,因为溶液呈中性,则![]() ,所以
,所以![]() ,据此进行分析。
,据此进行分析。
(1)![]()
![]()
![]()
![]()
根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ,即
,即![]() ,
,
故答案为:![]() ;
;
(2)由图可知,A点时反应正向进行,即![]() ;碘单质的转化率为
;碘单质的转化率为![]() ,则
,则![]() ,
,![]() ,由
,由![]() 可知
可知![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)反应三段式

则达到平衡状态时,氢气的物质的量分数![]() ;
;
平衡分压![]() 、
、![]() ,所以
,所以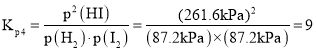 ;
;
由于反应![]() ,则
,则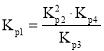 ,则
,则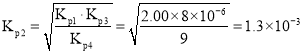 ,
,
故答案为:![]() ;9;
;9;![]() ;
;
(4)A.反应达平衡前,气体颜色在变,颜色不再变化,则说明反应达平衡,故A正确;
B.由于此反应的反应物和生成物均为气体,即体系中气体的总质量不变,而此反应前后气体的物质的量也不变,所以气体的平均相对分子质量始终不变,即不能说明反应体系达到平衡状态,故B错误;
C.由于反应物均为气体,且反应前后质量守恒,且容器为恒容的容器,所以气体密度始终不变,即气体密度不变不能说明反应是否达平衡,故C错误;
D.化学变化过程中伴随着能量的变化,所以温度不再变化说明反应体系达到平衡状态,故D正确,
故选:AD;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性即
的氨水等体积混合后,溶液呈中性即![]() ,电荷守恒关系为
,电荷守恒关系为![]() ,则
,则![]() ,故以
,故以![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是__,②可直接进入人体血液补充能量的是__,③可用作食品防腐剂的是___,④常用作食品着色剂的是__,⑤常用作治疗胃酸过多的抗酸剂的是__。
(2)保护环境,人人有责。①空气质量监测中,不需要监测的指标是__。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是__;后通入氯气或二氧化氯,其作用是___。
③对垃圾需要分类处理。如图所示的垃圾分类标志的含义是__。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的__性。

②钢铁在酸雨中会发生吸氧腐蚀,其正极反应为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
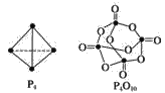
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—PakJ·mol-1、P—ObkJ·mol-1、P=OckJ·mol-1、O=OdkJ·mol-1。根据图示的分子结构和有关数据计算该反应的反应热______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究NO2与过氧化钠反应的情况,甲、乙两位同学设计了如下实验,其装置如图。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是________________,仪器B的作用是________________________。
(2)装入药品前必须检查装置的气密性,具体操作方法是________________________。
(3)试管中生成NO2反应的离子方程式是________________________________________。
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是__________。为验证自己的想法,乙同学对上述装置进行了改进,具体做法是________________。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是 ;
(2)(CH3CH2)2C(CH3)2的名称为 ;
(3)2-甲基-1-丁烯的键线式 ;
(4)相对分子质量最小的有机物分子式 ,糖尿病患者尿液中含的糖类结构简式 ;
(5) 所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
(6)3-甲基戊烷的一氯代产物有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。回答下列问题:
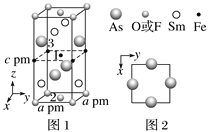
(1)AsH3的沸点比NH3的________(填“高”或“低”),其判断理由是______。
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为____________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=______________g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ,
, ![]() ,
, ![]() ),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com