
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。回答下列问题:
(1)AsH3的沸点比NH3的________(填“高”或“低”),其判断理由是______。
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
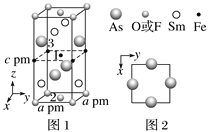
(3)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为____________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=______________g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ,
, ![]() ,
, ![]() ),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
【答案】低 NH3分子间存在氢键 4f 5 SmFeAsO1-xFx ![]() (
(![]() ,
, ![]() , 0) (0, 0,
, 0) (0, 0, ![]() )
)
【解析】
(1)由于氨分子间存在氢键,所以AsH3的沸点低于NH3。
(2)Sm为62号元素钐,根据其价层电子排布式4f66s2,可知价层电子排布式为4f5。
(3)据图分析,图中Sm原子个数为![]() ,铁原子个数为
,铁原子个数为![]() ,As的原子个数为
,As的原子个数为![]() ,O和F原子个数一共为
,O和F原子个数一共为![]() ,所以该化合物的化学式表示为SmFeAsO1-xFx;晶胞密度
,所以该化合物的化学式表示为SmFeAsO1-xFx;晶胞密度![]() 。根据坐标系中的信息可知原子2和3的坐标分别为(
。根据坐标系中的信息可知原子2和3的坐标分别为(![]() ,
, ![]() , 0)、(0, 0,
, 0)、(0, 0, ![]() )。
)。
(1)由于氨分子间存在氢键,所以AsH3的沸点低于NH3;
故答案为:低;NH3分子间存在氢键;
(2)Sm为62号元素钐,根据其价层电子排布式4f66s2,可知价层电子排布式为4f5;
故答案为:4f5;
(3)据图分析,图中Sm原子个数为![]() ,铁原子个数为
,铁原子个数为![]() ,As的原子个数为
,As的原子个数为![]() ,O和F原子个数一共为
,O和F原子个数一共为![]() ,所以该化合物的化学式表示为SmFeAsO1-xFx;晶胞密度
,所以该化合物的化学式表示为SmFeAsO1-xFx;晶胞密度![]() 。根据坐标系中的信息可知原子2和3的坐标分别为(
。根据坐标系中的信息可知原子2和3的坐标分别为(![]() ,
, ![]() , 0)、(0, 0,
, 0)、(0, 0, ![]() );
);
故答案为:SmFeAsO1-xFx;![]() ;(
;(![]() ,
, ![]() , 0);(0, 0,
, 0);(0, 0, ![]() )。
)。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
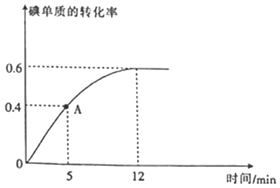
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制乙醇制取乙烯并检验其性质的装置图,请回答:
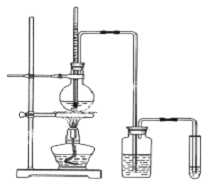
(1)写出圆底烧瓶中反应的方程式______,反应类型______;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:______。
(3)为了检验乙烯的生成,试管中应盛放______,现象为______;
(4)洗瓶中盛放的试剂为______,作用______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3A(g)+B(g)![]() C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
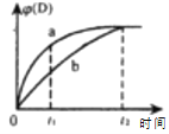
A.b曲线t2后,v正(B)=4 v逆(D)
B.a曲线t1时,v正(A)>3 v逆(B)
C.升高温度,可使曲线b变为曲线a
D.缩小反应容器的体积,可使曲线a变为曲线b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)请写出F离子的电子排布式_________。
(2)写出X的化学式________,X的化学名称为______。
(3)写出X涉及化工生产中的一个化学方程式:__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:____________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为__________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。
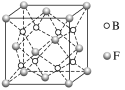
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B. 工业合成氨中,将氨气液化分离
C. A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D. 对于反应2NO2(g)![]() N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
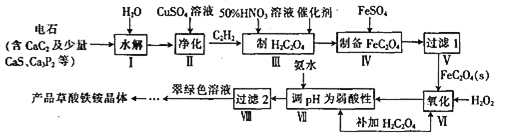
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
则火箭燃料的燃烧反应为2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=__。
(2)已知反应N2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0molL-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )

A.该反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com