
【题目】下面是实验室制乙醇制取乙烯并检验其性质的装置图,请回答:
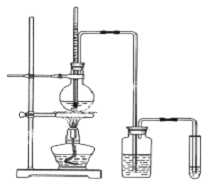
(1)写出圆底烧瓶中反应的方程式______,反应类型______;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:______。
(3)为了检验乙烯的生成,试管中应盛放______,现象为______;
(4)洗瓶中盛放的试剂为______,作用______。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 消去反应 C+2H2SO4(浓)
CH2=CH2↑+H2O 消去反应 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 高锰酸钾溶液(或溴的四氯化碳溶液) 溶液褪色 氢氧化钠溶液 吸收SO2和CO2
CO2↑+2SO2↑+2H2O 高锰酸钾溶液(或溴的四氯化碳溶液) 溶液褪色 氢氧化钠溶液 吸收SO2和CO2
【解析】
在实验室中用乙醇与浓硫酸混合加热170℃发生消去反应制取乙烯;浓硫酸具有脱水性,将乙醇脱水炭化形成碳单质,产生的碳和具有强氧化性的热的浓硫酸反应生成二氧化碳、二氧化硫和水,SO2、CH2=CH2都可以使高锰酸钾溶液和溴水褪色,可根据SO2是酸性氧化物,用碱将其除去后再检验乙烯。
(1)利用乙醇在浓硫酸的催化作用下发生消去反应制取乙烯,反应方程式为CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)乙醇被浓硫酸脱水炭化产生成碳单质,碳被浓硫酸氧化成二氧化碳,硫酸被碳还原成SO2,化学方程式:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)高锰酸钾具有强氧化性,乙烯含有不饱和的碳碳双键,能被高锰酸钾溶液氧化,高锰酸钾溶液被还原,溶液褪色,因此可以用酸性KMnO4溶液检验乙烯,现象是溶液褪色;乙烯分子中含有不饱和的碳碳双键,能与溴水中的溴单质发生加成反应而使溴水褪色,因此也可以使用溴水检验乙烯,现象是溶液褪色;
(4)浓硫酸与乙醇反应产生的杂质SO2气体具有还原性,可以被酸性KMnO4溶液或溴水氧化而使溶液褪色,干扰乙烯的检验,所以在检验乙烯气体之前,可根据SO2是酸性氧化物,与碱反应产生可溶性盐和水的性质,用NaOH溶液除去杂质SO2,CO2,反应方程式为:SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是__,②可直接进入人体血液补充能量的是__,③可用作食品防腐剂的是___,④常用作食品着色剂的是__,⑤常用作治疗胃酸过多的抗酸剂的是__。
(2)保护环境,人人有责。①空气质量监测中,不需要监测的指标是__。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是__;后通入氯气或二氧化氯,其作用是___。
③对垃圾需要分类处理。如图所示的垃圾分类标志的含义是__。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的__性。

②钢铁在酸雨中会发生吸氧腐蚀,其正极反应为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是 ;
(2)(CH3CH2)2C(CH3)2的名称为 ;
(3)2-甲基-1-丁烯的键线式 ;
(4)相对分子质量最小的有机物分子式 ,糖尿病患者尿液中含的糖类结构简式 ;
(5) 所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
(6)3-甲基戊烷的一氯代产物有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝试剂的结构简式如图所示,下列有关铝试剂的说法错误的是
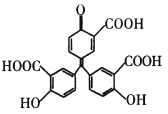
A.铝试剂分子中氢原子数目为16
B.1 mol铝试剂最多消耗3 mo1NaHCO3
C.铝试剂分子中所有碳原子可能在同一平面上
D.铝试剂能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。回答下列问题:
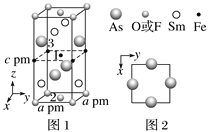
(1)AsH3的沸点比NH3的________(填“高”或“低”),其判断理由是______。
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为____________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=______________g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ,
, ![]() ,
, ![]() ),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com