
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
【答案】C
【解析】
A. 0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,反应过程中盐酸浓度减小,反应停止,故生成的氯气分子数为小于0.1NA,A错误;
B. 0.1mol铁粉与足量水蒸气反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,据此计算生成的H2分子数目应为0.13NA,B错误;
Fe3O4+4H2,据此计算生成的H2分子数目应为0.13NA,B错误;
C. N2和NH3 均存在3对共用电子,分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA,C正确;
D. Cu2(OH)2CO3与稀硫酸反应生成硫酸铜、水和CO2,故加入0.05mol的Cu2(OH)2CO3固体相当于加入0.1mol的CuO和0.05mol的H2O,由此推断阴极铜离子放电析出铜0.1mol,氢离子放电放出氢气0.05mol,阳极氢氧根离子放电,则转移电子的物质的量为:![]() ,则该电解过程中转移电子的数目为0.3NA,D错误;
,则该电解过程中转移电子的数目为0.3NA,D错误;
故选C。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)CO2(g)+Cu(s)和反应②H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K3。则下列说法中正确的是( )
A.反应①的平衡常数K1=![]()
B.反应③的平衡常数K3=![]()
C.对于反应③,恒容时,温度升高,氢气的浓度减小,则该反应的ΔH > 0
D.对于反应②,增加CuO的量,平衡正移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CaSO4(s)![]() Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)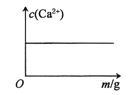
B.加少量蒸馏水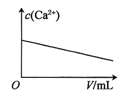
C.加少量硫酸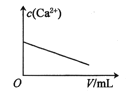
D.适当升高温度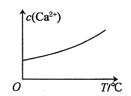
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
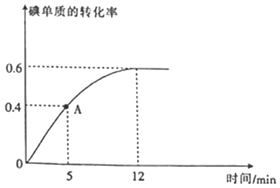
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气是一种清洁能源,氧气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ![]()
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ![]()
2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ![]()
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中不正确的是( )
A.分子式为C4H8的同分异构体共有(不考虑立体异构)5种
B.苯的四氯取代物有3种
C.分子式为C5H10O2的同分异构体中属于酯的有8种
D.![]() 的一溴取代物有4种
的一溴取代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制乙醇制取乙烯并检验其性质的装置图,请回答:
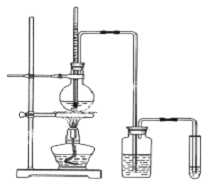
(1)写出圆底烧瓶中反应的方程式______,反应类型______;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:______。
(3)为了检验乙烯的生成,试管中应盛放______,现象为______;
(4)洗瓶中盛放的试剂为______,作用______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
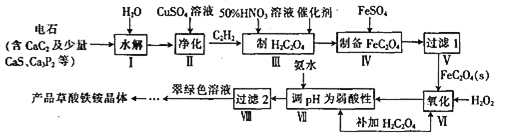
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com