
【题目】已知反应①CO(g)+CuO(s)CO2(g)+Cu(s)和反应②H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K3。则下列说法中正确的是( )
A.反应①的平衡常数K1=![]()
B.反应③的平衡常数K3=![]()
C.对于反应③,恒容时,温度升高,氢气的浓度减小,则该反应的ΔH > 0
D.对于反应②,增加CuO的量,平衡正移
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如图:

(1)FeSO4溶液显弱酸性的原因是_____(用离子方程式表示)。
(2)加入浓硫酸调节pH的作用是:①_____;②_____。
(3)写出加入H2O2发生反应的离子方程式:_____。
(4)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl6,Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
①用HgCl2除去过量的SnCl2的目的是_____。
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol·L-1K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80mL。则聚铁中铁元素的质量分数为_____%。
(5)某高效净水剂是由K2FeO4得到的,工业上以硫酸铁溶液、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,生产金属镉的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 mol/L)
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是__________。
(2)操作Ⅰ产生的滤渣主要成分为________(填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为______。
②再加入ZnO控制反应液的pH,pH范围为______。
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案鉴别________。
(4)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态镓原子的价电子排布式为___。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__和+3。砷的电负性比镓__(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,GaCl3、GaBr3、GaI3的熔、沸点依次升高,分析其变化原因:__。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是__。
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:___。
②反应物AsH3分子的几何构型为__,(CH3)3Ga中镓原子杂化方式为__。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为__,晶体的密度为__(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
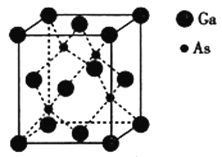
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料均为石墨)。

(1)图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
(2)SO32-放电的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。
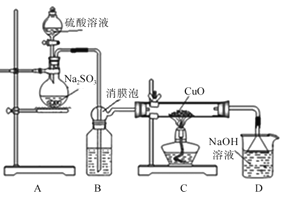
回答下列相关问题:
I.SO2还原CuO的探究
(1)装置B中宜放入的试剂为__,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
II.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为__(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值__(填“偏大”或“偏小”)。为减少实验误差.滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是__,②可直接进入人体血液补充能量的是__,③可用作食品防腐剂的是___,④常用作食品着色剂的是__,⑤常用作治疗胃酸过多的抗酸剂的是__。
(2)保护环境,人人有责。①空气质量监测中,不需要监测的指标是__。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是__;后通入氯气或二氧化氯,其作用是___。
③对垃圾需要分类处理。如图所示的垃圾分类标志的含义是__。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的__性。

②钢铁在酸雨中会发生吸氧腐蚀,其正极反应为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com