
����Ŀ���ۺ���������ƾ���[Fe2(OH)n(SO4)(3-0.5n)]m(n>2��m��10)����һ�ָ�Ч�����߷��ӻ���������ˮ����ʵ������������������ȡ�ۺ�����������Ҫ������ͼ��

��1��FeSO4��Һ�������Ե�ԭ����_____(�����ӷ���ʽ��ʾ)��
��2������Ũ�������pH�������ǣ���_____����_____��
��3��д������H2O2������Ӧ�����ӷ���ʽ��_____��
��4���ⶨ�����к������ķ���Ϊ�Ѿ������ڹ������У����ù�����SnCl2��Fe3+��ԭ��Fe2+���ټ���HgCl2��Һ��ȥ������SnCl2��Ȼ���ñ���K2Cr2O7��Һ(�ȼ��뼸����������ָʾ��)�ζ���Һ�е�Fe2+���˹��̷����IJ��ַ�ӦΪ��Sn2++2Hg2++8Cl-=Hg2Cl2��+SnCl6��Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O��
����HgCl2��ȥ������SnCl2��Ŀ����_____��
�ڳ�ȡ��������Ϊ10.00g���100.0mL��Һ��ȡ��20.00mL��������������������0.1000mol��L-1K2Cr2O7����Һ�ζ����ﵽ�յ�ʱ������K2Cr2O7����Һ12.80mL�����������Ԫ�ص���������Ϊ_____%��
��5��ij��Ч��ˮ������K2FeO4�õ��ģ���ҵ������������Һ��������غ���������Ϊԭ���Ʊ�K2FeO4���÷�Ӧ�Ļ�ѧ����ʽ��_____��
���𰸡�Fe2++H2O![]() Fe(OH)2+2H+ ����Fe2+ˮ�� ���H2O2����������(��ٽ�Fe2+������) 2Fe2++2H++H2O2=2Fe3++2H2O ��ֹ�ζ�����������Sn2+ͬʱ��ԭCr2O72-����ɽϴ��ʵ����� 21.5% Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O
Fe(OH)2+2H+ ����Fe2+ˮ�� ���H2O2����������(��ٽ�Fe2+������) 2Fe2++2H++H2O2=2Fe3++2H2O ��ֹ�ζ�����������Sn2+ͬʱ��ԭCr2O72-����ɽϴ��ʵ����� 21.5% Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O
��������
��1���������ӷ���ˮ�⣬�ƻ�ˮ�ĵ���ƽ��ʹ��Һ�����ԣ�
��2������������������Һ����ˮ�⼰����������˫��ˮ����������ǿ���з�����
��3��˫��ˮ����ǿ�����ԣ��ܹ����������������������ӣ��ݴ�д����Ӧ�����ӷ���ʽ��
��4���ٸ���Sn2+�ܹ���ԭ![]() ����ɽϴ��ʵ���������жϣ�
����ɽϴ��ʵ���������жϣ�
�ڸ��ݹ�ϵʽ6Fe2+��![]() ����������������ʵ��������������������������������
����������������ʵ��������������������������������
��5������������ԭ��Ӧ��ʧ�����غ��ԭ���غ�д���仯ѧ����ʽ��
��1����Һ��Fe2+���ӷ���ˮ Fe2++2H2O![]() 2H++Fe(OH)2���ƻ�ˮ�ĵ���ƽ�⣬��Һ�����ԣ��ʴ�Ϊ��Fe2++2H2O
2H++Fe(OH)2���ƻ�ˮ�ĵ���ƽ�⣬��Һ�����ԣ��ʴ�Ϊ��Fe2++2H2O![]() Fe(OH)2+2H+��
Fe(OH)2+2H+��
��2��������������Һ��������ˮ�⣬����Ũ���ᣬ������Һ�������ӣ���������Fe2+ˮ�⣬��һ����Ҫ����˫��ˮ�����������ӣ�˫��ˮ��������������������ǿ������Ũ�����������˫��ˮ�������������ʴ�Ϊ������Fe2+ˮ�⣻���H2O2��������������ٽ�Fe2+����������
��3������������Һ�м���˫��ˮ���������ӱ�˫��ˮ�����������ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++2H++H2O2=2Fe3++2H2O��
��4����Sn2+�ܹ���![]() ����������Ϊ��ֹ�ζ�����������Sn2+ͬʱ��ԭ
����������Ϊ��ֹ�ζ�����������Sn2+ͬʱ��ԭ![]() ����ɽϴ��ʵ������Ҫ��HgCl2��ȥ������SnCl2���ʴ�Ϊ����ֹ�ζ�����������Sn2+ͬʱ��ԭ
����ɽϴ��ʵ������Ҫ��HgCl2��ȥ������SnCl2���ʴ�Ϊ����ֹ�ζ�����������Sn2+ͬʱ��ԭ![]() ����ɽϴ��ʵ����
����ɽϴ��ʵ����
�� ��![]() ��֪��
��֪��
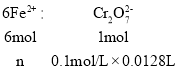 �����n=0.00768mol���ʾ�����������������Ϊ��
�����n=0.00768mol���ʾ�����������������Ϊ��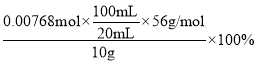 =21.5%��
=21.5%��
��5���������������ɸ�����أ���Ԫ�ػ��ϼ�����3�ۣ�������ر���ԭΪ�Ȼ��أ���Ԫ�ػ��ϼ۽���2�ۣ��ʷ�Ӧ����ʽ���������������ص�ϵ��֮��Ϊ1:3������ԭ���غ���ƽ�䷽��ʽΪ��Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NaOH��Һ���кͷ�Ӧû�����Ե�����ijѧϰ��ȤС���ͬѧΪ��֤��NaOH��Һ����������ᷢ���˷�Ӧ�����кͷ�Ӧ����ЧӦ��������������漸��ʵ�鷽������ش��й����⣺
��1������һ����ͼװ��ʵ��װ�ã�ͼ��С�Թ���ϸ�ߵ��ţ�ϸ�ߵ��϶�˩��ϸ��˿�ϡ���ʼʱʹ�Ҷ�U�ι����˺�īˮ��ƽ��ʵ�鿪ʼ�����²�ϸ��˿��ʹС�Թ���������ƿ��NaOH��Һ��ϣ���ʱ�۲쵽��������________________________________��ԭ����______________________________

��2������������С�������Ӧ��Һ�¶ȵı仯���жϷ�Ӧ�ķ��������NaOH��Һ��������ǰ�����¶ȵı仯����֤�������˻�ѧ��Ӧ����С��ͬѧ����ͬŨ�ȵ�NaOH��Һ�������10 mL��ϣ����¶ȼƲ�����Ӧǰ���¶ȵı仯����õIJ����������±���

��x��______
��3����HNO3(aq)��NaOH(aq)=NaNO3(aq)��H2O(l)����H����57.3 kJ��mol��1�����У���ϡH2SO4��Ba(OH)2(aq)����ŨH2SO4��Ba(OH)2(aq)����ϡHNO3��Ba(OH)2(aq)��Ӧ����1 mol H2O(l)�ķ�Ӧ�ȷֱ�Ϊ��H1����H2����H3������H1����H2����H3������С����Ĺ�ϵΪ______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ��λ�ڶ������ڣ����ǵ�ԭ���������ε�����Aԭ�Ӻ��ڽ���һ�����ӣ�Bԭ�ӵĵ���������Dԭ��������������ȡ�Dԭ������������������Ӳ�����3�����ɴ��ƶϣ�
(1)A��D��ɻ������У����зǼ��Լ��ķ��ӵĵ���ʽΪ___________
(2)B��D��ɵĻ������У����ڷǼ��Է��ӵĵ���ʽΪ____________
(3)A��C��ɵĻ��������ʽ�ĵ���ʽΪ____________����_____���ӡ�(���������������Ǽ�����)
(4)��֪A��B��C��D�����һ�ֻ������ԭ�Ӹ�����8 ��1 ��2 ��3�û�����Ļ�ѧʽΪ_______����_____������(��������������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢��ӵ�����ΪNA������������ȷ����
A.1molD2O����������Ϊ12NA��B.1molNa2O2������ˮ��Ӧת�Ƶ�����Ϊ2NA��
C.10g ��������ԭ����Ϊ0.5NA��D.�����22.4L�����麬��ԭ����Ϊ12NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1molX��1molY���з�Ӧ��2X(g)+Y(g)![]() Z(g)����60s�ﵽƽ�⣬����0.3molZ������˵����ȷ���ǣ� ��
Z(g)����60s�ﵽƽ�⣬����0.3molZ������˵����ȷ���ǣ� ��
A.�����������Ϊ20L��Z��ƽ��Ũ�ȱ�Ϊԭ����һ��
B.������ѹǿ��������Y��ת���ʼ�С
C.�������¶ȣ�X���������������÷�Ӧ�ġ�H��0
D.��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ��mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ��mol-1
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��____��
��2��������ȼ������ʱ�����ķ�ӦΪN2(g)+O2(g)![]() 2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T��ʱ����5L�����ܱ������г���6.5molN2��7.5molO2����5minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ���5mol(�����Ǻ�����Ӧ)����5min�ڸ÷�Ӧ��ƽ������v(NO)=_____����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T��ʱ����5L�����ܱ������г���6.5molN2��7.5molO2����5minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ���5mol(�����Ǻ�����Ӧ)����5min�ڸ÷�Ӧ��ƽ������v(NO)=_____����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
��3������β����Ҳ����CO����֪CO�ܷ������淴Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41kJ��mol-1��
CO2(g)+H2(g) ��H=-41kJ��mol-1��
����ij�����г���1.0molH2O(g)��1.0molCO(g)����һ�������·���������Ӧ�����������CO�����ʵ���(mol)��ʱ���ϵ���±���ʾ��
0 | 5min | 10min | 15min | 20min | 25min | |
��(800��) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
��(800��) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
���ʵ���ʵ���ı������������_____��
������ʼʱ�����������Ͷ��һ����������̼����������һ�������·����������淴Ӧ������ͼ����ȷ����˵�����淴Ӧ�Ѵﵽƽ��״̬����_____(����ĸ)��
A.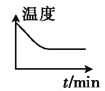 B.
B. C.
C.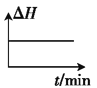 D.
D.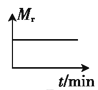
��4������ClO2�����������ﷴӦ�������£�NO![]() NO2
NO2![]() N2
N2
��Ӧ��IJ����л�������ǿ�����ɣ�����������NO2�����ʵ�����ȣ����仯ѧ����ʽ��___�����б�״����11.2LN2���ɣ�������ClO2___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL��1��NaOH��Һ�ֱ�ζ������Ũ�Ⱦ�Ϊ20.00mL 0.100molL��1������ʹ���ζ�������ͼ��ʾ������˵��������ǣ�������

A. a��ʾ���Ǵ���ĵζ�����
B. �ζ�b�����У�ָʾ�������Ƿ�̪
C. pH��7ʱ���ζ��������ĵ�V��NaOH����20.00mL
D. V��NaOH����10.00mLʱ��������c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��CO(g)��CuO(s)CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)Cu(s)��H2O(g)����ͬ�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)CO2(g)��H2(g)��ƽ�ⳣ��ΪK3��������˵������ȷ����(����)
A.��Ӧ�ٵ�ƽ�ⳣ��K1��![]()
B.��Ӧ�۵�ƽ�ⳣ��K3��![]()
C.���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�������Ũ�ȼ�С����÷�Ӧ����H > 0
D.���ڷ�Ӧ�ڣ�����CuO������ƽ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com