
【题目】常温下,0.01mol/L的一元碱溶液的pH为
A.≥2B.12C.≤12D.无法确定
科目:高中化学 来源: 题型:
【题目】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则H2=_________。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______(填序号)。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________,该温度下反应的平衡常数K=_______________。(答案可用分数表示)
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________。
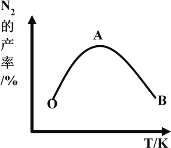
(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________(填序号)。
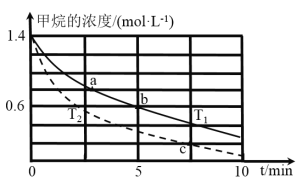
A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g);△H<0某研究小组研究了其他条件不变时,改变一条件对上述反应的影响,根据实验数据作出下列关系图:( )
2C(g);△H<0某研究小组研究了其他条件不变时,改变一条件对上述反应的影响,根据实验数据作出下列关系图:( )
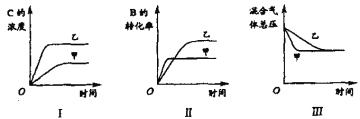
下列判断一定正确是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是压强对反应的影响,且甲的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某工业副产物盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3、MnCO3、SiO2、CaCO3等]为原料制备防火材料MgSO4·7H2O的工艺流程如图:
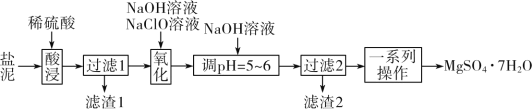
回答下列问题:
(1)以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2。已知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为__。
(2)“酸浸”时,FeCO3与稀硫酸反应的化学方程式为__。滤渣1的主要成分为SiO2和__(填化学式);为了提高浸取率,除了适当增大稀硫酸的浓度和升温外,还可采取的措施有__(写出两点)。
(3)“氧化”时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__;滤渣2的主要成分为MnO2和__、__(填化学式)。
(4)“一系列操作”主要是__。
(5)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图像。____________________
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是____________________。
(3)图中5号元素在周期表中的位置是________周期________族。
(4)图中出现的元素中最活泼的金属元素位于元素周期表的________周期________族。
(5)写出图中6号元素的价电子排布式:________。
(6)分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围________<Al<________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极
C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如图:

(1)FeSO4溶液显弱酸性的原因是_____(用离子方程式表示)。
(2)加入浓硫酸调节pH的作用是:①_____;②_____。
(3)写出加入H2O2发生反应的离子方程式:_____。
(4)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl6,Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
①用HgCl2除去过量的SnCl2的目的是_____。
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol·L-1K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80mL。则聚铁中铁元素的质量分数为_____%。
(5)某高效净水剂是由K2FeO4得到的,工业上以硫酸铁溶液、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com