
【题目】在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g);△H<0某研究小组研究了其他条件不变时,改变一条件对上述反应的影响,根据实验数据作出下列关系图:( )
2C(g);△H<0某研究小组研究了其他条件不变时,改变一条件对上述反应的影响,根据实验数据作出下列关系图:( )
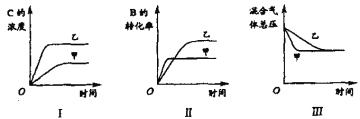
下列判断一定正确是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是压强对反应的影响,且甲的压强较高
【答案】C
【解析】
A.图I中,根据斜率大小可知,在乙条件下的化学反应速率,明显比在甲条件下的化学反应速率快;在乙条件下C的平衡浓度,比在甲条件下的C的平衡浓度大,相比较而言,条件乙既有利于此反应的化学反应速率增大又有利于平衡向正反应方向移动。说明甲、乙两个条件不仅影响化学反应速率,而且影响化学平衡,而催化剂不影响化学平衡,故A错误;
B.图Ⅱ根据斜率大小可知,在乙条件下的化学反应速率,比在甲条件下的化学反应速率慢,如果甲、乙两个条件是压强对反应的影响,从化学反应速率来讲,是甲的压强较高,而在乙条件下B的转化率,比在甲条件下B的转化率高,说明条件乙有利于平衡向正反应方向移动,而所给反应正反应气体体积减小,不符合勒夏特列原理,故B错误;
C.温度高化学反应速率快,则甲的温度高,但是由于正反应放热,升高温度平衡左移,B的转化率减小,不利于反应向正反应方向进行,故C正确;
D.压强改变,可逆反应A(g)+3B(g) ![]() 2C(g)平衡状态发生改变,则图Ⅲ研究的不可能是压强对反应的影响,应该是催化剂对反应速率的影响,故D错误;
2C(g)平衡状态发生改变,则图Ⅲ研究的不可能是压强对反应的影响,应该是催化剂对反应速率的影响,故D错误;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设KCl的摩尔质量为a g/mol, 20℃时某KCl饱和溶液的物质的量浓度为b mol/L,该溶液的密度为ρg/cm3 (ρ﹥1),下列说法不正确的是( )
A.20℃ KCl的溶解度为100ab/(1000ρ-ab) g
B.KCl的质量分数为(ab/1000ρ)×100%
C.将此溶液蒸发部分水再恢复到20℃,溶液密度一定大于ρ g/cm3
D.20℃密度小于ρ g/cm3的KCl溶液是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是______________________________

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:

则x=______
(3)若HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在农药、制药行业中用途广泛,沸点为77℃,遇水剧烈反应,液面上产生白雾,并产生带有刺激性气味的气体。实验室用干燥的Cl2和SO2与SCl2反应合成SOCl2,反应原理是:SO2+Cl2+SCl2=2SOCl2。回答以下问题:
Ⅰ.氯化亚砜的制备
实验室拟用以下装置完成氯化亚砜的制备:
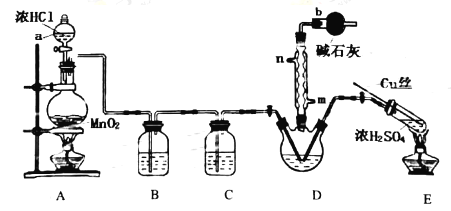
(1)仪器a的名称是__;装置D中冷凝管的冷凝水入口是__。
(2)装置A中反应的离子方程式__;装置E中反应的化学方程式__。
(3)B、C所盛试剂分别是__、__;装置D中干燥管b的作用是__。
(4)本实验的主要副产物是SCl2,已知:SOCl2沸点为77℃,SCl2的沸点为50℃,提纯SOCl2的实验操作是__;
Ⅱ.氯化亚的性质与检测
经分析,某实验小组的同学认为,SOCl2与水反应后的溶液中有盐酸和亚硫酸生成。
(5)欲证明SOCl2与水反应后形成的溶液中有H2SO3生成,可以使用的试剂是__;欲证明纯净SOCl2与水反应后形成的溶液中有Cl-,实验的操作方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是 ( )
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是 ( )
A.Ra元素位于元素周期表中第六周期ⅡA族B.RaCl2的熔点比CaCl2高
C.一个![]() 原子中含有138个中子D.Ra(OH)2是一种两性氢氧化物
原子中含有138个中子D.Ra(OH)2是一种两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
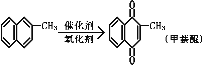
在某次合成反应中,用1.4g(0.01mol)的α-甲基萘,才制得0.17g(0.001mol)甲萘醌,已知该反应的速率是快的。试判断导致其产率低的原因是( )
A.使用了过量的催化剂B.没有用乙酸,而是使用其它催化剂
C.把反应混合物加热D.所生成的甲基醌是沉淀物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素位于短周期内,它们的原子序数依次递增。A原子核内仅有一个质子,B原子的电子总数与D原子最外层电子数相等。D原子最外层电子数是其电子层数的3倍。由此推断:
(1)A与D组成化合物中,含有非极性键的分子的电子式为___________
(2)B与D组成的化合物中,属于非极性分子的电子式为____________
(3)A与C组成的化合物分子式的电子式为____________属于_____分子。(填“极性”或“非极性”)
(4)已知A、B、C、D可组成一种化合物,且原子个数比8 :1 :2 :3该化合物的化学式为_______属于_____化合物(填“离子”或“共价”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100molL﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是( )

A. a表示的是醋酸的滴定曲线
B. 滴定b过程中,指示剂可以是酚酞
C. pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com