
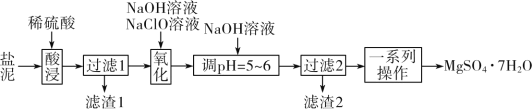
【题目】以某工业副产物盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3、MnCO3、SiO2、CaCO3等]为原料制备防火材料MgSO4·7H2O的工艺流程如图:
回答下列问题:
(1)以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2。已知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为__。
(2)“酸浸”时,FeCO3与稀硫酸反应的化学方程式为__。滤渣1的主要成分为SiO2和__(填化学式);为了提高浸取率,除了适当增大稀硫酸的浓度和升温外,还可采取的措施有__(写出两点)。
(3)“氧化”时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__;滤渣2的主要成分为MnO2和__、__(填化学式)。
(4)“一系列操作”主要是__。
(5)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理:__。
【答案】![]() FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O CaSO4 粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等) Mn2++ClO+2OH=MnO2↓+Cl+H2O Fe(OH)3 Al(OH)3 蒸发浓缩、冷却结晶、过滤 4MgCO3·Mg(OH)2·5H2O
FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O CaSO4 粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等) Mn2++ClO+2OH=MnO2↓+Cl+H2O Fe(OH)3 Al(OH)3 蒸发浓缩、冷却结晶、过滤 4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O
5MgO+4CO2↑+6H2O
【解析】
根据流程:盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3,MnCO3、SiO2、CaCO3等]用稀硫酸酸浸,得到MnSO4、MgSO4、Al2(SO4)3、FeSO4的混合溶液和不溶的SiO2和CaSO4,过滤,滤渣I的主要成分为SiO2和CaSO4,向滤液中加入NaOH、NaClO溶液,可以将Mn2+氧化为MnO2,将Fe2+氧化为Fe3+,调节pH在5~6时沉淀Fe3+和Al3+,过滤,滤渣2为MnO2和Fe(OH)3、Al(OH)3,最后将含有MgSO4的溶液蒸发浓缩、冷却结晶、过滤得到MgSO47H2O,据此分析作答。
⑴以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2,C22含有三对共用电子对,又知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为![]() ;故答案为:
;故答案为:![]() 。
。
⑵“酸浸”时,FeCO3与稀硫酸反应的化学方程式为FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O,根据分析,滤渣I的主要成分为SiO2和CaSO4,适当增大稀硫酸的浓度、升温、粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等)可以提高浸取率;故答案为:FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O;CaSO4;粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等)。
⑶氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为:Mn2++ClO+2OH=MnO2↓+Cl+H2O;根据分析滤渣2的主要成分为MnO2和Fe(OH)3、Al(OH)3;故答案为:Mn2++ClO+2OH=MnO2↓+Cl+H2O;Fe(OH)3;Al(OH)3。
⑷由含有MgSO4的溶液蒸发浓缩、冷却结晶、过滤得到MgSO47H2O;故答案为:蒸发浓缩、冷却结晶、过滤。
⑸一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理,在高温下发生反应:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O,生成的MgO和CO2可以防火保温;故答案为:4MgCO3·Mg(OH)2·5H2O
5MgO+4CO2↑+6H2O,生成的MgO和CO2可以防火保温;故答案为:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O。
5MgO+4CO2↑+6H2O。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某温度(T℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__;此溶液中各离子的浓度由大到小的排列顺序是_____。
(2)若所得混合溶液的pH=2,则a∶b=____;此溶液中各种离子的浓度由大到小的排列顺序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在农药、制药行业中用途广泛,沸点为77℃,遇水剧烈反应,液面上产生白雾,并产生带有刺激性气味的气体。实验室用干燥的Cl2和SO2与SCl2反应合成SOCl2,反应原理是:SO2+Cl2+SCl2=2SOCl2。回答以下问题:
Ⅰ.氯化亚砜的制备
实验室拟用以下装置完成氯化亚砜的制备:
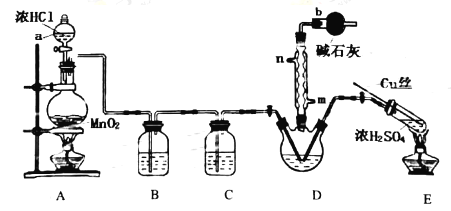
(1)仪器a的名称是__;装置D中冷凝管的冷凝水入口是__。
(2)装置A中反应的离子方程式__;装置E中反应的化学方程式__。
(3)B、C所盛试剂分别是__、__;装置D中干燥管b的作用是__。
(4)本实验的主要副产物是SCl2,已知:SOCl2沸点为77℃,SCl2的沸点为50℃,提纯SOCl2的实验操作是__;
Ⅱ.氯化亚的性质与检测
经分析,某实验小组的同学认为,SOCl2与水反应后的溶液中有盐酸和亚硫酸生成。
(5)欲证明SOCl2与水反应后形成的溶液中有H2SO3生成,可以使用的试剂是__;欲证明纯净SOCl2与水反应后形成的溶液中有Cl-,实验的操作方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
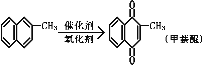
在某次合成反应中,用1.4g(0.01mol)的α-甲基萘,才制得0.17g(0.001mol)甲萘醌,已知该反应的速率是快的。试判断导致其产率低的原因是( )
A.使用了过量的催化剂B.没有用乙酸,而是使用其它催化剂
C.把反应混合物加热D.所生成的甲基醌是沉淀物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素位于短周期内,它们的原子序数依次递增。A原子核内仅有一个质子,B原子的电子总数与D原子最外层电子数相等。D原子最外层电子数是其电子层数的3倍。由此推断:
(1)A与D组成化合物中,含有非极性键的分子的电子式为___________
(2)B与D组成的化合物中,属于非极性分子的电子式为____________
(3)A与C组成的化合物分子式的电子式为____________属于_____分子。(填“极性”或“非极性”)
(4)已知A、B、C、D可组成一种化合物,且原子个数比8 :1 :2 :3该化合物的化学式为_______属于_____化合物(填“离子”或“共价”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
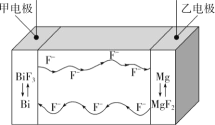
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.将容器体积变为20L,Z的平衡浓度变为原来的一半
B.若增大压强,则物质Y的转化率减小
C.若升高温度,X的体积分数增大,则该反应的△H>0
D.以X浓度变化表示的反应速率为0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入标况下的CO21.12L后,将溶液小心蒸干后得到不含结晶水的固体5.08g,则下列说法中正确的是 ( )
A.原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3
B.原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3
C.原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH
D.原NaOH溶液的浓度是0.900mol/L,所得固体是Na2CO3和NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com