
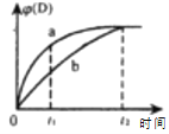
【题目】已知反应:3A(g)+B(g)![]() C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
A.b曲线t2后,v正(B)=4 v逆(D)
B.a曲线t1时,v正(A)>3 v逆(B)
C.升高温度,可使曲线b变为曲线a
D.缩小反应容器的体积,可使曲线a变为曲线b
【答案】B
【解析】
图象信息告诉我们,反应时间为0时,D的体积分数为0,则表明反应从反应物开始。在相同时间内,a曲线的反应速率快,且达平衡时两种条件下D的体积分数相同,则表明改变的反应条件为压强或使用催化剂,a曲线的压强大或使用了催化剂。
A.b曲线t2后,反应达平衡,此时v正(B):v逆(D)=1:4,则v正(D)=4 v逆(B),A不正确;
B.a曲线t1时,反应正向进行,此时v正(A)>v逆(A),而此时v逆(A)=3 v逆(B),所以v正(A)>3 v逆(B),B正确;
C.升高温度,平衡逆向移动,平衡时D的体积分数减小,不能使曲线b变为曲线a,C不正确;
D.缩小反应容器的体积,可使曲线b变为曲线a,D不正确;
故选B。


科目:高中化学 来源: 题型:
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是 ;
(2)(CH3CH2)2C(CH3)2的名称为 ;
(3)2-甲基-1-丁烯的键线式 ;
(4)相对分子质量最小的有机物分子式 ,糖尿病患者尿液中含的糖类结构简式 ;
(5) 所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
所含官能团的名称是 ;该有机物发生加聚反应后,所得产物的结构简式为 ;
(6)3-甲基戊烷的一氯代产物有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝试剂的结构简式如图所示,下列有关铝试剂的说法错误的是
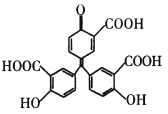
A.铝试剂分子中氢原子数目为16
B.1 mol铝试剂最多消耗3 mo1NaHCO3
C.铝试剂分子中所有碳原子可能在同一平面上
D.铝试剂能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法中正确的是
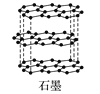
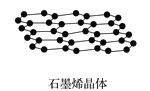
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp2杂化,每个sp2杂化轨道含![]() s轨道与
s轨道与![]() p轨道
p轨道
C.石墨属于混合晶体,层与层之间存在分子间作用力;层内碳原子间存在共价键;石墨能导电,存在金属键
D.石墨烯中平均每个六元碳环含有3个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。回答下列问题:
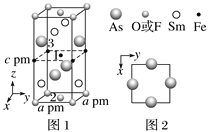
(1)AsH3的沸点比NH3的________(填“高”或“低”),其判断理由是______。
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为____________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=______________g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ,
, ![]() ,
, ![]() ),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
),则位于底面中心的原子2和铁原子3的坐标分别为___________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6mol·L-1硫酸溶液中,乙同学将电极放入6mol·L-1的氢氧化钠溶液中,如图所示。
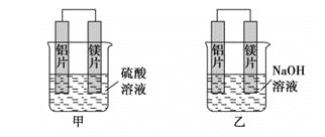
(1)写出甲池中正极的电极反应式__。
(2)写出乙池中负极的电极反应式__。
(3)写出乙池中总反应的离子方程式__。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__活动性更强,而乙会判断出__活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(________)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法__(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案__(如可靠,此空可不填)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com