
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

【答案】![]() sp3 正四面体形 109°28′ 5:1 > Ca的原子半径较大,且价电子较少,金属键较弱 12
sp3 正四面体形 109°28′ 5:1 > Ca的原子半径较大,且价电子较少,金属键较弱 12 ![]()
【解析】
(1)Fe为26号元素,失去最外层3个电子形成Fe3+,所以Fe3+价层电子的轨道表达式(电子排布图)为![]() ;
;
(2)SiH4分子中心Si原子的价层电子对数为![]() ,孤电子对数为0,为sp3杂化,空间构型为正四面体,键角为109°28′;Si2H4分子结构与C2H4,有一个Si=Si双键,四个Si-H单键,所以σ键和π键的数目之比5:1;
,孤电子对数为0,为sp3杂化,空间构型为正四面体,键角为109°28′;Si2H4分子结构与C2H4,有一个Si=Si双键,四个Si-H单键,所以σ键和π键的数目之比5:1;
(3)Mg的最外层为半满状态,其第一电离大于同周期相邻元素,所以第一电离能Mg>Al;
(4)金属的熔沸点与金属键强弱有关,与Fe相比Ca的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低;
(5)以顶点的原子分析,位于面心的原子与之相邻最近,1个顶点原子为12个面共用,故配位数为12;根据其晶胞模型可知,面对角线上三个原子相切,设晶胞边长为acm,则有2a2=(4r)2,解得a=![]() cm,则晶胞体积V=a3=
cm,则晶胞体积V=a3=![]() cm3;根据均摊法可知该晶胞含有Ag原子个数为
cm3;根据均摊法可知该晶胞含有Ag原子个数为![]() ,所以晶胞的质量m=
,所以晶胞的质量m=![]() ,则晶胞的密度
,则晶胞的密度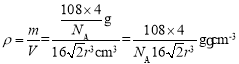 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入标况下的CO21.12L后,将溶液小心蒸干后得到不含结晶水的固体5.08g,则下列说法中正确的是 ( )
A.原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3
B.原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3
C.原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH
D.原NaOH溶液的浓度是0.900mol/L,所得固体是Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列各组中的物质制备和收集少量相应气体,能采用下图实验装置的是①浓氨水与固体NaOH ②浓硫酸与食盐 ③稀硝酸与铜片 ④过氧化氢溶液与MnO2 ⑤镁条与稀硫酸 ⑥电石与水( )

A.①②⑥B.②④C.①②③⑥D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式正确的是( )
A.CH2=CH2+Br2→CH3—CHBr2
B.C2H4+3O2![]() 2CO2+2H2O
2CO2+2H2O
C.CH3CH2OH+Na→CH3CH2Na+H2O
D.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CaSO4(s)![]() Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)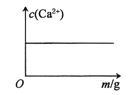
B.加少量蒸馏水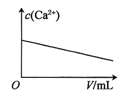
C.加少量硫酸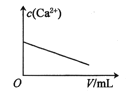
D.适当升高温度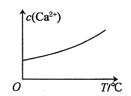
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下三个热化学方程式
H2(g)+ ![]() O2(g)=H2O(g) ΔH1=a kJ·mol-1
O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(l) ΔH2=b kJ·mol-1
O2(g)=H2O(l) ΔH2=b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=c kJ·mol-1
关于它们的下列表述正确的是( )
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
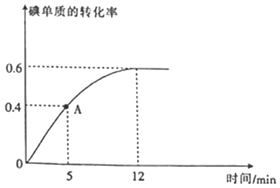
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中不正确的是( )
A.分子式为C4H8的同分异构体共有(不考虑立体异构)5种
B.苯的四氯取代物有3种
C.分子式为C5H10O2的同分异构体中属于酯的有8种
D.![]() 的一溴取代物有4种
的一溴取代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3A(g)+B(g)![]() C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
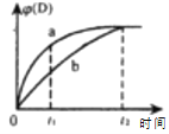
A.b曲线t2后,v正(B)=4 v逆(D)
B.a曲线t1时,v正(A)>3 v逆(B)
C.升高温度,可使曲线b变为曲线a
D.缩小反应容器的体积,可使曲线a变为曲线b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com