
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6mol·L-1硫酸溶液中,乙同学将电极放入6mol·L-1的氢氧化钠溶液中,如图所示。
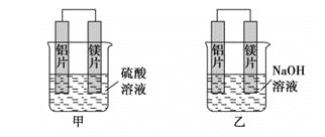
(1)写出甲池中正极的电极反应式__。
(2)写出乙池中负极的电极反应式__。
(3)写出乙池中总反应的离子方程式__。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__活动性更强,而乙会判断出__活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(________)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法__(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案__(如可靠,此空可不填)。
【答案】2H++2e-=H2↑ 2Al+8OH--6e-=2AlO2-+4H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ Mg Al AD 不可靠 将两种金属作电极连上电流计后插入电解质溶液,构成原电池,利用电流计测定电流的方向,从而判断电子流动方向,再确定原电池正负极
【解析】
甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由于铝与碱的反应是一个特例,不可作为判断金属性强弱的依据。判断原电池的正极、负极要依据实验事实。
(1)甲中镁与硫酸优先反应,甲池中正极上氢离子得电子产生氢气,电极反应式为:2H++2e-=H2↑;
(2)乙池中负极上铝失电子在碱性条件下生成AlO2-,电极反应式为2Al+8OH--6e-=2AlO2-+4H2O;
(3)乙池中铝与氢氧化钠反应,镁与氢氧化钠不反应,总反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(5)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;、
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故选AD;
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法不可靠。可行实验方案如:将两种金属作电极连上电流计后插入电解质溶液,构成原电池,利用电流计测定电流的方向,从而判断电子流动方向,再确定原电池正负极。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应:3A(g)+B(g)![]() C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。下列分析正确的是( )
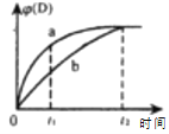
A.b曲线t2后,v正(B)=4 v逆(D)
B.a曲线t1时,v正(A)>3 v逆(B)
C.升高温度,可使曲线b变为曲线a
D.缩小反应容器的体积,可使曲线a变为曲线b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
则火箭燃料的燃烧反应为2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=__。
(2)已知反应N2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0molL-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0]丁烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与1,3-丁二烯互为同分异构体
B. 二氯代物共有4种
C. 碳碳键只有单键且彼此之间的夹角有45°和90°两种
D. 每一个碳原子均处于与其直接相连的原子构成的四面体内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ·mol-1、285.8kJ·mol-1、890.3kJ·mol-1、2800kJ·mol-1,则下列热化学方程式正确的( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ·mol-1
O2(g)=CO(g) ΔH=-393.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )

A.该反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.2.0gCO2与SO2的混合气体分子中,含有的质子数为NA
B.7.1gCl2与100mL1.0mol·L-1NaOH溶液反应,转移电子数为0.1NA
C.17gNH3与48gO2在催化剂作用下充分反应,得到NO分子数为NA
D.标准状况下,2.24LCH4和C3H6混合气体中,含有极性键数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。完成下列填空:

(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有___________
(2)上述装置中,A是___________溶液,其作用是___________ 。
(3)上述装置中,B物质是___________。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的____________类,为了将石蜡从饭盒中溶出,应选用下列试剂中的__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com